
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:

提示:2CrO42-+2H+ ![]() Cr2O72-+H2O
Cr2O72-+H2O
(1)写出过程I中铝发生的离子方方程式_______________。
(2)溶液1中的阴离子有CrO42-、 ___________。
(3)过程I中,Cr2O3参与的反应中,若生成0.4 mol CrO42-,消耗氧化剂的物质的量是________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,其可用来冶炼Al,冶炼Al原理___________。
②滤渣B受热分解所得物质可以循环利用,B是___________。
(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II得到K2Cr2O7粗品的操作是:_______________,过滤得到K2Cr2O7粗品。
【答案】 2Al+2OH-+2H2O= 2AlO2-+3H2↑ AlO2-、OH- 0.3 mol 2Al2O3(熔融)![]() 3O2↑+ 4Al NaHCO3 向滤液3中加入稀盐酸和KCl固体后,蒸发浓缩、降温结晶
3O2↑+ 4Al NaHCO3 向滤液3中加入稀盐酸和KCl固体后,蒸发浓缩、降温结晶
【解析】试题分析:本题考查工艺流程的分析,涉及离子方程式和化学方程式的书写,氧化还原反应的计算,物质的分离、提纯,图表数据的分析。根据铬渣的成分以及图示,过程I中Al、Al2O3与NaOH反应生成NaAlO2,Cr2O3被氧化成Na2CrO4,水浸后的溶液1中含Na2CrO4、NaAlO2和过量NaOH;溶液1中通入CO2调pH=9,NaAlO2与CO2反应生成Al(OH)3沉淀,滤渣A的成分为Al(OH)3;滤液2中通入CO2调pH=6,部分Na2CrO4转化为Na2Cr2O7,滤渣B受热分解所得物质可循环利用,结合CO2与NaAlO2的反应和流程,过滤得到的滤渣B的主要成分为NaHCO3。
(1)过程I中Al与NaOH反应生成NaAlO2和H2,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(2)根据上述分析溶液1中的阴离子有CrO42-、AlO2-和OH-。
(3)过程I中Cr2O3被氧化成CrO42-,氧化剂为O2,根据得失电子守恒,4n(O2)=3n(CrO42-),消耗的氧化剂氧气物质的量为![]() n(CrO42-)=
n(CrO42-)=![]() 0.4mol=0.3mol。
0.4mol=0.3mol。
(4)①滤渣A为Al(OH)3,Al(OH)3煅烧得Al2O3和H2O,电解熔融的Al2O3得到Al,冶炼Al的原理为2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。
②滤渣B受热分解所得物质可以循环利用,则滤渣B是NaHCO3。
(5)由于要获得K2Cr2O7,所以要使CrO42-尽可能多的转化成Cr2O72-,使反应2CrO42-+2H+ ![]() Cr2O72-+H2O正向移动,需要向滤液3中加入酸;将滤液3中的Na2Cr2O7转化为K2Cr2O7需要向滤液3中加入钾盐,从表中数据可见,低温时K2Cr2O7的溶解度最小,但K2SO4的溶解度与K2Cr2O7的差别不大,所以向滤液3中加入KCl固体。过程II得到K2Cr2O7粗品的操作是:向滤液3中加入稀盐酸和KCl固体后,蒸发浓缩、降温结晶。
Cr2O72-+H2O正向移动,需要向滤液3中加入酸;将滤液3中的Na2Cr2O7转化为K2Cr2O7需要向滤液3中加入钾盐,从表中数据可见,低温时K2Cr2O7的溶解度最小,但K2SO4的溶解度与K2Cr2O7的差别不大,所以向滤液3中加入KCl固体。过程II得到K2Cr2O7粗品的操作是:向滤液3中加入稀盐酸和KCl固体后,蒸发浓缩、降温结晶。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
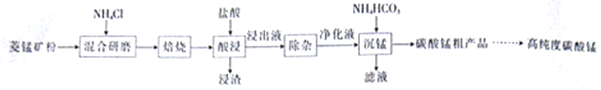
【题目】工业上采用氨化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:
已知相关信息如下:
①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3.2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应:MnCO3+2NH4C1![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:
难溶物 | Mn(OH)2 | MnCO3 | CaF2 | MgF2 |
Ksp | 2.0×10-13 | 2.0×10-11 | 2.0×10-10 | 7.0×10-11 |
(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、![]() 分别为_____、_____、_____、。
分别为_____、_____、_____、。
(2)“除杂“过程如下:
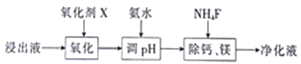
①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O8>H2O2>Cl2>MnO2>Fe3+,则氧化剂X宜选择_______(填字母)。
A. (NH4)2S2O8 B.MnO2 C.H2O2 D. Cl2
②调节pH时,pH可取的最低值为________。
③当CaF2、MgF2 两种沉淀共存时,若溶液中c(Ca2+) =1.0×10-5mol/L,则c(Mg2+) =_____mol/L。
(3)“沉锰”过程中,不用碳酸钠溶液替代NH4HCO3溶液,可能的原因是____________。
(4)测定碳酸锰粗产品的纯度。实验步骤:
①称取0.5000g碳酸锰粗产品于300mL作锥形瓶中,加少量水湿润。再加25mL磷酸,移到通风橱内加热至240℃,停止加热,立即加入2g硝酸铵,保温,充分反应后,粗产品中的碳酸锰全部转化为Mn(PO4)2]3-,多余的硝酸铵全部分解。用氨气赶尽锥形瓶内的氮氧化物,冷却至室温。
②将上述锥形瓶中的溶液加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定,发生的反应为:
[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3+ +2PO43-。到达滴定终点时,消耗的硫酸亚铁铵标准溶液的体积为20.00mL。
计算:碳酸锰粗产品的纯度=________。
误差分析:若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg·L-1) | 成分 | 含量/(mg·L-1) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 | HCO3- | 142 |
SO42- | 2560 | Br- | 64 |
Mg2+ | 1272 |
(1)电渗析法淡化海水示意图如下图所示;其中阴(阳)离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是____________。
②在阴极附近产生少量白色沉淀,两种主要的成分为____________。
③淡水的出口为_______(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①从MgCl2·6H2O晶体得到无水MgCl2的主要实验操作是_______________。
②依据上述流程,若将0.5m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为_________L(忽略Cl2溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列分散系:①有尘埃的空气 ②盐酸 ③硫酸铜溶液 ④稀豆浆,能观察到丁达尔效应的是( )
A. ①② B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,由加成反应引起的是
A.乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色
B.甲烷与氯气混合后,光照黄绿色消失
C.在催化剂存在下,乙烯与水反应生成乙醇
D.丙烯通入溴水中,溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com