
【题目】下列物质与水混合后静置,不出现分层的是( )
A.三氯甲烷
B.乙醇
C.苯
D.四氯化碳
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:

提示:2CrO42-+2H+ ![]() Cr2O72-+H2O
Cr2O72-+H2O
(1)写出过程I中铝发生的离子方方程式_______________。
(2)溶液1中的阴离子有CrO42-、 ___________。
(3)过程I中,Cr2O3参与的反应中,若生成0.4 mol CrO42-,消耗氧化剂的物质的量是________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,其可用来冶炼Al,冶炼Al原理___________。
②滤渣B受热分解所得物质可以循环利用,B是___________。
(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II得到K2Cr2O7粗品的操作是:_______________,过滤得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B. 用铜为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D. 用FeCl3溶液腐蚀印刷电路板上铜箱:2Fe3++Cu=2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的腐蚀.请写出正极反应式: .
②若开始时开关K与b连接时,两极均有气体产生,则N端是电源的极(填正或负),则总反应的离子方程式为 .
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠. ①制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)导出.通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数.
②通电开始后,阴极附近溶液pH会增大,请简述原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应中,升高温度,平衡常数减小的是( )
A.2SO3?2SO2+O2
B.H2PO ![]() +H2O?HPO
+H2O?HPO ![]() +H3O+
+H3O+
C.Fe3++3H2O?Fe(OH)3+3H+
D.CH3COOH+OH﹣?CH3COO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
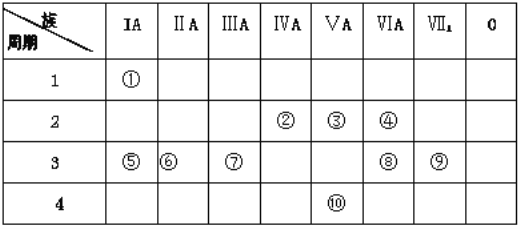
(1)从⑤到⑨元素中非金属性较强的元素是_________(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是 _________ (填化学式)。
(2)写出元素④具有强氧化性的氢化物的电子式:_______________。
(3)写出一种由①、③、④三种元素形成的常见离子化合物:________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
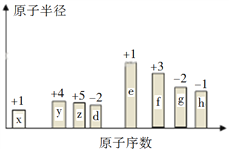
请回答下列问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_________________;比较g、h的最高价氧化物对应的水化物的酸性强弱:________________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1 mol·L1 R溶液的烧杯中滴加1 mol·L1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
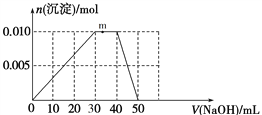
①写出m点反应的离子方程式_____________________________。
②若R溶液改加20 mL1.2 mol·L1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法错误的是( )
A.硅晶体是一种重要的半导体材料,可制作计算机芯片
B.二氧化硅性质稳定,不与任何酸发生反应
C.水泥、玻璃、陶瓷都是硅酸盐产品
D.龙泉青瓷原料[Al2Si2O5(OH)4]用氧化物表示为:Al2O32SiO22H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式,正确的是( )
A. 过量的氨气与氯气反应:2NH3+3Cl2![]() N2+6HCl
N2+6HCl
B. 利用HF雕刻玻璃:SiO2+4H++4F—=SiF4+2H2O
C. 石灰乳吸收泄漏的液氯:2Cl2+2Ca(OH)2=2Ca2++2Cl—+2ClO—+2H2O
D. SO2的尾气处理:OH—+SO2=SO32—+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com