
【题目】下列物质中,可用于治疗胃酸过多的是
A. 氢氧化铝 B. 硫酸钙 C. 苏打 D. 硫酸钡
科目:高中化学 来源: 题型:
【题目】有关天然产物水解的叙述不正确的是
A. 纤维素水解与淀粉水解得到的最终产物不同
B. 可用碘检验淀粉水解是否完全
C. 蛋白质水解的最终产物均为氨基酸
D. 油脂水解可得到丙三醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O来表示的化学反应是( )。
A.CH3COOH+NaOH==CH3COONa+H2O
B.HNO3+KOH=KNO3+H2O
C.H2SO4+Ba(OH)2=BaSO4↓+2H2O
D.2HCl+Cu(OH)2=CuCl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应 A2(g) +B2(g)=2AB(g) ΔH,其能量变化如图所示,下列叙述正确的是
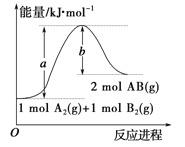
A. 断裂 1 mol A2 和 1 mol B2 中的化学键,放出a kJ 能量
B. ΔH=+(a-b)kJ·mol-1
C. 每生成 2 个AB分子吸收 b kJ 热量
D. 该反应中反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】任何一个化学反应中都会伴随能量变化和物质变化。
(1)下图为氢气和氧气生成1mol水蒸气时的能量变化情况。
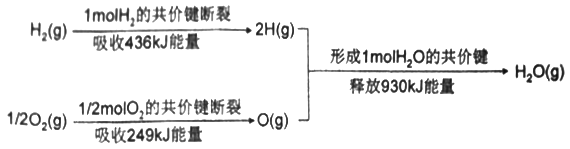
生成1mol水蒸气时,形成新化学键所释放的总能量_____断开旧化学键所吸收的总能量(填“大于”“小于”或“等于”),因此水的分解反应为________(填“吸热”或“放热”)反应。
(2)随着科学技术的发展和社会进步,各种各样的电器不断进入现代社会,化学电源大大丰富和方便了我们的生活、学习和工作。原电池中发生的化学反应属于______。镁铝原电池,电解质用稀硫酸,则其负极的电极反应式为______;电解质用氢氧化钠溶液,电池工作时,溶液中的OH-移向_____极(“镁”或“铝”)。
(3)在三个容器均为2L的密闭容器中发生反应:2HI(g) ![]() H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量(mol)随反应时间(min)的变化情况如下表所示,表中温度的单位为摄氏度(℃)。
H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量(mol)随反应时间(min)的变化情况如下表所示,表中温度的单位为摄氏度(℃)。
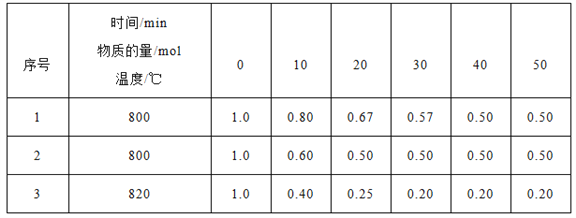
①实验1和实验2中,有一个实验使用了催化剂,则使用了催化剂的是实验_____(填“1”或“2”)。
②实验1中,20min~30min间生成I2(g)的平均反应速率为_____,实验3的反应达到化学反应限度时H2(g)物质的量的百分数为_______。
③下列物理量不再变化时,能判断实验3中反应达到化学反应限度的是__________。
A.混合气体颜色 B.混合气体密度 C.混合气体总压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用 FeCl3 溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL 废液加入足量的 AgNO3 溶液,生成沉淀 8.61g。(2)另取 10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断错误的是
A. 一定含有 Fe 2+、 Fe 3+、 Cu2+、 Clˉ B. c(Fe2+):c(Cu2+) = 2:1
C. c(Clˉ) = 6mol / L, c(Fe 2+) = 1.2mol / L D. c (Fe2+):c(Fe 3+) = 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol -1
2SO3(g) ΔH=-196.6 kJ·mol -1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= 。
(2)下图是一种用NH3脱除烟气中NO的原理。
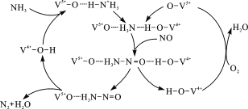
①该脱硝原理中,NO最终转化为H2O和_____________(填化学式)。
②当消耗1 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为__________L。
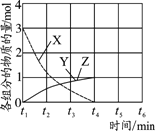
(3)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如右图所示,写出NO分解的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为
A.7.84L B.6.72L C.4.48L D.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com