

 2NaAlO2+CO2↑,
2NaAlO2+CO2↑, 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;

科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
- 2 |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省常州市高三第一次月考化学试卷(解析版) 题型:填空题
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取A12O3、 K2CO3等物质,工艺流程如下:
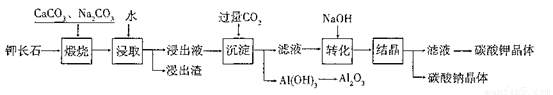
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的 化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和 KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O Al(OH)3+OH-。
Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州市毕业班综合测试(一)理综化学试卷(解析版) 题型:推断题
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取A12O3、 K2CO3等物质,工艺流程如下:

(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的 化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和 KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O Al(OH)3+OH-。
Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三4月联考理综化学试卷(解析版) 题型:填空题
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
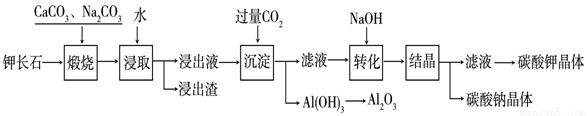
(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是: 。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O 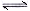 Al(OH)3
+ OH— ,“浸取”时应保持溶液呈
性(填“酸”或“碱”)。
Al(OH)3
+ OH— ,“浸取”时应保持溶液呈
性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是 、 和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是 。长时间电解后,需要更换新的石墨电极的是 极(填“阴”或“阳”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com