
【题目】用KMnO4氧化盐酸溶液.反应方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56L,
计算
(1)参加反应的HCl的物质的量?
(2)反应中被氧化的HCl的物质的量?
(3)并用双线桥标出电子转移的方向和数目.
【答案】
(1)解:反应生成Cl2在标准状况下体积为56L,则氯气的物质的量为n= ![]() =
= ![]() =2.5mol,则参加反应的HCl的物质的量为2.5mol×
=2.5mol,则参加反应的HCl的物质的量为2.5mol× ![]() =8mol;
=8mol;
答:参加反应的HCl的物质的量为8mol
(2)解:反应中16molHCl只有8mol被氧化,即被氧化的HCl占总的HCl物质的量 ![]() ,所以反应中被氧化的HCl的物质的量为4mol;
,所以反应中被氧化的HCl的物质的量为4mol;
答:反应中被氧化的HCl的物质的量为4mol
(3)解:2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e﹣,双线桥标出电子的转移方向和数目为 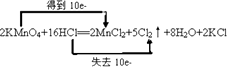 ,
,
答:并用双线桥标出电子转移的方向和数目
【解析】反应生成Cl2在标准状况下体积为56L,根据n= ![]() 计算物质的量,再根据方程式计算HCl,结合元素化合价的变化分析.
计算物质的量,再根据方程式计算HCl,结合元素化合价的变化分析.


科目:高中化学 来源: 题型:
【题目】在100℃时,体积不变的密闭容器中发生如下反应:A(g) ![]() 2B(g) ΔH>0,每隔一定时间对该容器内的物质进行分析,得到如下表格,试填空:
2B(g) ΔH>0,每隔一定时间对该容器内的物质进行分析,得到如下表格,试填空:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(A)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 | c5 |
c(B) (mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)达到平衡时A的转化率为________。在此条件下,平衡常数K为______。
(2)在0~60s时间段内,A的平均反应速率为_________________。
(3)要使平衡向正反应方向移动,可采取的措施______(填序号)。
A、体积不变时增大的A起始浓度 B、升高温度
C、使用催化剂 D、缩小容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的乳浊液 ②含有泥沙的食盐水 ③溶有碘(I2)的碘化钾溶液 ④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表).
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )
A.①﹣(3)﹣分液
B.②﹣(2)﹣过滤
C.③﹣(2)﹣萃取
D.④﹣(1)﹣蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或测量数据的说法正确的是( )
A.用托盘天平称量食盐的质量为12.35gB.中和热的测定实验中,NaOH溶液应该稍过量
C.用pH试纸测量次氯酸钠溶液的pH为11D.用碱式滴定管量取高锰酸钾溶液20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 向四羟基合铝酸钠溶液中滴加过量的碳酸氢钠溶液:[Al(OH)4]—+4H+=Al3++2H2O
B. 将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
C. NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH—=BaSO4↓+2H2O
D. 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O=Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)===C(g) ΔH,分两步进行:
①A(g)+B(g)===X(g) ΔH1
②X(g)===C(g) ΔH2
反应过程中能量变化如下图所示,E1表示A+B===X的活化能,下列说法正确的是
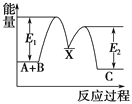
A. ΔH1=ΔH-ΔH2>0
B. X是反应A(g)+B(g)===C(g)的催化剂
C. E2是反应②的反应热
D. ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲烷的燃烧热为890.3 kJ/mol请完成表示甲烷燃烧的热化学方程式
_____________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )

A. X可能含有2种盐
B. 气体a通入双氧水,可实现“绿色”转化
C. Y主要含有(NH4)2SO4,回收利用作化肥
D. (NH4)2S2O8中S的化合价为+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某MgCl2溶液的密度为1.6g·cm-3,其中镁离子的质量分数为10 %,300 mL该溶液中Cl-离子的物质的量约等于
A. 4.0 mol B. 3.0 mol C. 2.0 mol D. 1.0 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com