
【题目】某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )

A. X可能含有2种盐
B. 气体a通入双氧水,可实现“绿色”转化
C. Y主要含有(NH4)2SO4,回收利用作化肥
D. (NH4)2S2O8中S的化合价为+7
【答案】D
【解析】A项,SO2与氨水反应生成X,当SO2少量时生成(NH4)2SO3,SO2过量时生成NH4HSO3,因不知SO2是否过量,所以X可能是(NH4)2SO3、NH4HSO3中的一种或两种盐,故A正确;B项,在X中加入过量硫酸时,无论X是(NH4)2SO3、NH4HSO3中的一种或两种盐,都和过量的与硫酸反应生成SO2气体和(NH4)2SO4,所以气体a是SO2,当加入双氧水时,发生SO2+H2O2=H2SO4,产物只有一种,符合绿色化学的思想,故B正确;C项,根据B项分析可知,Y的主要成分是(NH4)2SO4,可以用在氮肥,故C正确;D项,在(NH4)2S2O8中,因S元素的最高化合价是+6价,则不可能是+7价,故D错误。此题答案选D。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】如图是某燃煤发电厂处理废气的装置示意图.下列说法正确的是( ) 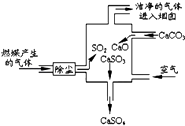
A.此过程中没有分解反应
B.整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2
C.使用此废气处理装置可减少CO2的排放
D.此过程中S元素的化合价未发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液.反应方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56L,
计算
(1)参加反应的HCl的物质的量?
(2)反应中被氧化的HCl的物质的量?
(3)并用双线桥标出电子转移的方向和数目.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法的目的与改变化学反应速率无关的是
A.牛奶在冰箱里保存
B.向玻璃中加入氧化铅
C.高炉炼铁前先将铁矿石粉碎
D.在糕点包装内放置小包除氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活、生产中的问题不能用平衡移动原理解释的是
A. 实验室可以用排饱和食盐水的方法收集氯气
B. 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C. 高压有利于工业上合成氨
D. 打开汽水瓶时,瓶中立即泛起大量泡沫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地球上分布最广、最常用的金属之一。请回答下列关于Fe元素的问题:
(1) FeCl3溶液显酸性,其原因是(用离子方程式表示)________________________。
不断加热FeCl3溶液时,蒸干其水分并灼烧得到的固体是______________________。
(2)在配制FeCl3溶液时,为防止浑浊,应加入_______________。
(3)向FeCl3溶液中加入少量NaHCO3浓溶液,预计可能看到的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2______(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是____________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_____________mol·L-1。写出该混合溶液中的下列算式的精确结果 (数据不能做近似计算,不用化简)。c(Na+)-c(A-)=____________mol·L-1 c(OH-)-c(HA)=____________mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com