
【题目】某化学兴趣小组欲利用MnO2和浓盐酸及如图所示装置制备Cl2。下列分析中不正确的是
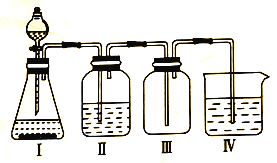
A.I中缺少加热装置
B.Ⅱ为净化Cl2的装置,其盛放的是NaOH溶液
C.Ⅲ为收集Cl2的装置
D.Ⅳ中处理多余的Cl2时,Cl2既作氧化剂,又作还原剂
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。请回答:
I.用如图所示装置进行第一组实验。
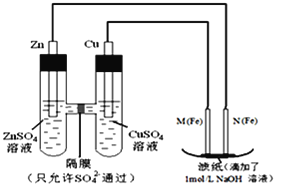
(1)N极发生反应的电极反应式为_________.
(2)实验过程中,SO42-______(填“从左向右”、“从右向左”或“不”)移动;
II.用如图所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
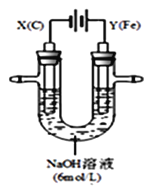
(3)电解过程中,X极区溶液的pH______(填“增大”、“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为_____________和4OH-- 4e-= 2H2O + O2↑
(5)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少______g
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题:
A. B.
B.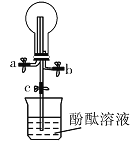
(1)实验室制备氨气的化学方程式为_______。
(2)用装置![]() 收集氨气时,氨气的进气口是______(填“
收集氨气时,氨气的进气口是______(填“![]() ”或“
”或“![]() ”),理由是__________。
”),理由是__________。
(3)打开装置![]() 中的止水夹
中的止水夹![]() ,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________、______________。
,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶液或气体X慢慢的加入或通入到一定量的Y溶液中,Y溶液产生沉淀的量与X的物质的量的关系可以用如图表示的是 :

A.X为NaOH溶液,Y为AlCl3溶液
B.X为CO2,Y为Ca(OH)2溶液
C.X为NH3,Y为Al2(SO4)3溶液
D.X为HCl,Y为Na[Al(OH)4]溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关描述不正确的是
A.新制饱和氯水和浓硝酸光照下均会有气体产生,其成分中都有氧气
B.灼烧NaOH固体时不能使用瓷坩埚,因为瓷坩埚中的SiO2能与NaOH反应
C.钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同
D.浓硫酸具有较强酸性,能与Cu反应生成H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
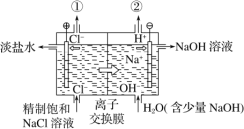
A.装置中发生反应的离子方程式为2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
B.装置中出口①处的物质是氯气,出口②处的物质是氢气
C.该离子交换膜只能让阳离子通过,不能让阴离子通过
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 是五种原子序数依次增大的前四周期元素。A、B、C是位于p区的同一周期的元素,C的价层电子排布为nsnnp2n,A与C原子核外的未成对电子数相等;DC2与BC2-为等电子体;E为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)E在周期表中的位置_____。
(2)与 E同区、同周期元素原子的价电子排布式是_____;C2-的电子排布图________。
(3)A、B、C均可与氢元素形成氢化物,它们的最简单氢化物稳定性由强到弱的排列顺序____ (填分子式)。
(4)A、B、C的最简单氢化物中,键角由大到小的顺序为_____(用分子式表示),其中 B的最简单氢化物的 VSEPR模型名称为_____,C的最简单氢化物的分子立体构型名称为________。
(5)A、C 两种元素能形成化合物 AC2,该分子的结构式_____,中心原子的杂化轨道类型_________ ,根据电子云重叠方式的不同,分子里共价键的类型有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于一定条件下的化学平衡H2(g)+I2(g)![]() 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
A.恒温恒容,充入H2,v(正)增大,平衡右移
B.恒温恒容,充入He,v(正)增大,平衡右移
C.加压,v(正),v(逆)不变,平衡不移动
D.升温,v(正)减小,v(逆)增大,平衡左移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com