
【题目】某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题:
A. B.
B.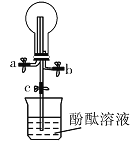
(1)实验室制备氨气的化学方程式为_______。
(2)用装置![]() 收集氨气时,氨气的进气口是______(填“
收集氨气时,氨气的进气口是______(填“![]() ”或“
”或“![]() ”),理由是__________。
”),理由是__________。
(3)打开装置![]() 中的止水夹
中的止水夹![]() ,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________、______________。
,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________、______________。
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】把2.3 g钠投入足量水中,充分反应后所得溶液用水稀释至100 mL。求:
(1)生成标准状况下的氢气多少升_______;
(2)所得的溶液物质的量浓度_______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
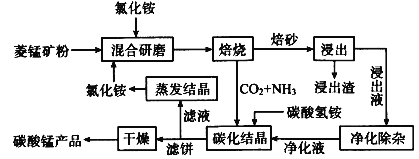
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+)=0.1molL -1形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为___。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②__将Al3+、Fe3+变为沉淀除去;③加入NH4F将__离子沉淀除去。写出反应①的离子方程式为___;
(3)碳化结晶时,反应的离子方程式为___。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是__。流程中能循环利用的物质除了氯化铵之外还有__。
(5)测定碳酸锰产品的纯度。
称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度__(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制氢气的一个重要反应是:CO(g) +H2O(g)== CO2(g)+H2(g)。
已知在25℃时:
①C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH1=111kJ·mol 1
CO(g) ΔH1=111kJ·mol 1
②H2(g)+![]() O2(g)== H2O(g) ΔH2=242kJ·mol 1
O2(g)== H2O(g) ΔH2=242kJ·mol 1
③C(s)+O2(g) == CO2(g) ΔH3=394kJ·mol 1
下列说法不正确的是
A. 25℃时,CO(g)+H2O(g)==CO2(g)+H2(g) ΔH=41kJ·mol1
B. 增大压强,反应①的平衡向逆反应方向移动,平衡常数K减小
C. 反应①达到平衡时,每生成1molCO的同时生成0.5molO2
D. 反应②断开2molH2和1molO2中的化学键所吸收的能量比形成4molO-H键所放出的能量少484kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及铝的化合物有着极为广泛的用途。
(1)金属铝的生产是以Al2O3为原料,在熔融状态下用石墨做阴极和阳极进行电解:
2Al2O3![]() 4Al+3O2↑,则电解时不断消耗的电极是_____(填“阳极”或“阴极”)
4Al+3O2↑,则电解时不断消耗的电极是_____(填“阳极”或“阴极”)
(2)铝片、石墨、空气和海水构成的原电池可用于航标供电,该原电池正极的电极反应是_____。
(3)泡沫灭火器中NaHCO3溶液和Al2(SO4)3溶液发生反应的离子方程式是______。
(4)在配制AlCl3溶液时,防止溶液出现浑浊现象,溶液中应加入_____。
(5)Mg(OH)2固体能除去镁盐溶液中Al3+,原因是_____。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组利用实验室中的一瓶未知白色固体粉末进行了如下实验:
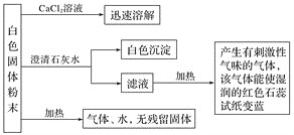
请回答下列问题:
(1)白色沉淀为______________________(填化学式,下同),产生的有刺激性气味的气体是_____________________。
(2)该白色固体粉末是___________________(填化学式)。
(3)写出该白色固体粉末受热分解的化学方程式:_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲利用MnO2和浓盐酸及如图所示装置制备Cl2。下列分析中不正确的是
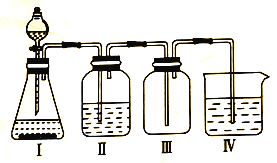
A.I中缺少加热装置
B.Ⅱ为净化Cl2的装置,其盛放的是NaOH溶液
C.Ⅲ为收集Cl2的装置
D.Ⅳ中处理多余的Cl2时,Cl2既作氧化剂,又作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g) △H=-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快); 4VO2+O2→2V2O5(慢),下列说法正确的是( )
2SO3(g) △H=-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快); 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A.反应速率主要取决于V2O5的质量B.VO2是该反应的催化剂
C.该反应逆反应的活化能大于198kJ/molD.升高温度,该反应的△H增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com