
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
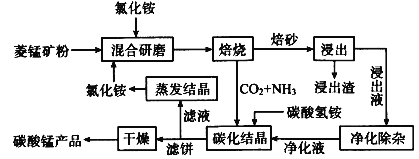
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+)=0.1molL -1形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为___。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②__将Al3+、Fe3+变为沉淀除去;③加入NH4F将__离子沉淀除去。写出反应①的离子方程式为___;
(3)碳化结晶时,反应的离子方程式为___。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是__。流程中能循环利用的物质除了氯化铵之外还有__。
(5)测定碳酸锰产品的纯度。
称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度__(填“偏高”“偏低”或“无影响”)。
【答案】MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O 调节溶液的pH Ca2+、Mg2+ MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O 调节溶液的pH Ca2+、Mg2+ MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Mn2++2HCO3-![]() MnCO3+CO2↑+H2O 碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀 CO2 92.00% 偏低
MnCO3+CO2↑+H2O 碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀 CO2 92.00% 偏低
【解析】
菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素,与氯化铵混合研磨后煅烧的固体中含有氯化锰、四氧化三铁、氧化铝、氧化钙和氧化镁,加入盐酸,浸出液中主要含有Al3+、Fe3+、Fe2+、Mn2+、Mg2+,经过净化后,在净化液中加入碳酸氢铵,使锰离子沉淀,生成MnCO3,最后得到高纯度MnCO3。根据此分析进行解答。
(1)“焙烧”过程的主要反应为碳酸锰与氯化铵发生反应,方程式为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
(2)已知Al3+、Fe3+完全沉淀的pH分别为5.2、2.8,不能影响Mn2+,故使用调节pH的方法来除去铝离子和铁离子。加入NH4F会生成CaF2、MgF2可用来除去Ca2+、Mg2+。①中MnO2将Fe2+氧化为Fe3+,自身反应为Mn2+,故离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。
(3)碳化结晶时Mn2+与碳酸氢根反应生成碳酸锰,离子方程式为:Mn2++2HCO3-![]() MnCO3+CO2↑+H2O。
MnCO3+CO2↑+H2O。
(4)碳酸钠溶液的碱性较强,c(OH-)较大,会产生Mn(OH)2沉淀,因此“沉锰”过程中,不用碳酸钠溶液替代NH4HCO3溶液。根据以上分析可知流程中能循环利用的物质除了氯化铵之外还有CO2。
(5)根据[Mn(PO4)2]3-+Fe2+=Mn2+ +Fe3++2PO43-可知,[Mn(PO4)2]3-的物质的量与硫酸亚铁铵的物质的量相等,则[Mn(PO4)2]3-的物质的量与硫酸亚铁铵的物质的量=0.2000mol/L×0.02L=0.004mol,根据锰元素守恒,0.5000g碳酸锰粗产品中碳酸锰的物质的量=0.004mol,碳酸锰粗产品的纯度=![]() ×100%=92.00%。若滴定终点时发现滴定管尖嘴处产生了气泡,导致标准溶液的体积偏小,则[Mn(PO4)2]3-的物质的量偏小,测得的碳酸锰粗产品的纯度偏低。
×100%=92.00%。若滴定终点时发现滴定管尖嘴处产生了气泡,导致标准溶液的体积偏小,则[Mn(PO4)2]3-的物质的量偏小,测得的碳酸锰粗产品的纯度偏低。


科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________。
(5)“赶氨”时,最适宜的操作方法是________________。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。请回答:
I.用如图所示装置进行第一组实验。
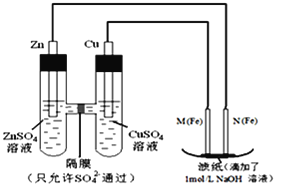
(1)N极发生反应的电极反应式为_________.
(2)实验过程中,SO42-______(填“从左向右”、“从右向左”或“不”)移动;
II.用如图所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
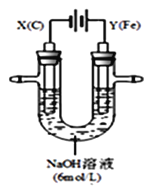
(3)电解过程中,X极区溶液的pH______(填“增大”、“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为_____________和4OH-- 4e-= 2H2O + O2↑
(5)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少______g
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。

①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1= a kJ·mol-1
②3AlCl(g) = 2Al(l)+ AlCl3(g) △H2= b kJ·mol-1
③Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3
下列说法正确的是
A.该电池的电解质可用氯化铝水溶液替代
B.Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3= (a-b) kJ·mol-1
C.该电池充电时石墨电极与电源正极相连
D.该电池放电时的负极反应方程式为 :Al-3e-+7AlCl4-=4Al2Cl7-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各粒子对应的立体构型及杂化方式均正确的是
选项 | 粒子 | 立体构型 | 杂化方式 |
A | SO3 | 平面三角形 | S原子采取sp2杂化 |
B | SO2 | V形 | S原子采取sp3杂化 |
C | CO32- | 三角锥形 | C原子采取sp2杂化 |
D | BeCl2 | 直线性 | Be原子采取sp杂化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质和条件已略去)。A、B、E、G、H、J常温下为气体,A为黄绿色,J为红棕色,B能使湿润的红色石蕊试纸变蓝,E是空气中含量最多的气体,C工业上用于制取漂白粉,K为一种红色金属单质,I是常见的无色液体。
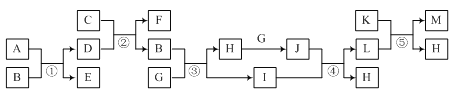
(1)E的化学式为___。
(2)反应②的化学方程式为___。
(3)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(4)反应⑤的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题:
A. B.
B.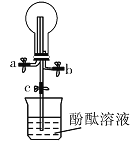
(1)实验室制备氨气的化学方程式为_______。
(2)用装置![]() 收集氨气时,氨气的进气口是______(填“
收集氨气时,氨气的进气口是______(填“![]() ”或“
”或“![]() ”),理由是__________。
”),理由是__________。
(3)打开装置![]() 中的止水夹
中的止水夹![]() ,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________、______________。
,继续通入氨气,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 是五种原子序数依次增大的前四周期元素。A、B、C是位于p区的同一周期的元素,C的价层电子排布为nsnnp2n,A与C原子核外的未成对电子数相等;DC2与BC2-为等电子体;E为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)E在周期表中的位置_____。
(2)与 E同区、同周期元素原子的价电子排布式是_____;C2-的电子排布图________。
(3)A、B、C均可与氢元素形成氢化物,它们的最简单氢化物稳定性由强到弱的排列顺序____ (填分子式)。
(4)A、B、C的最简单氢化物中,键角由大到小的顺序为_____(用分子式表示),其中 B的最简单氢化物的 VSEPR模型名称为_____,C的最简单氢化物的分子立体构型名称为________。
(5)A、C 两种元素能形成化合物 AC2,该分子的结构式_____,中心原子的杂化轨道类型_________ ,根据电子云重叠方式的不同,分子里共价键的类型有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com