
| A. | “O”既可以表示宏观上的氧元素,也可以表示微观的一个氧原子 | |
| B. | 烧碱、纯碱按物质分类都属于碱 | |
| C. | 氧气、臭氧均为氧单质,所以物理性质、化学性质完全相同 | |
| D. | 泡沫灭火器的灭火原理是降低了可燃物的着火点 |
分析 A.元素符号既可以表示宏观上的氧元素,也可以表示微观的一个氧原子;
B.纯碱是碳酸钠的俗称;
C.氧气、臭氧的分子组成不同,结构不同,所以物理性质、化学性质不相同;
D.物质的着火点不可能改变.
解答 解:A.元素符号“O”既可以表示宏观上的氧元素,也可以表示微观的一个氧原子,故A正确;
B.纯碱是碳酸钠的俗称,在物质分类上属于盐,故B错误;
C.氧气、臭氧均为氧单质,由于二者的分子组成不同,结构不同,所以物理性质、化学性质不相同,故C错误;
D.泡沫灭火器的灭火原理是可燃物与氧气隔绝,物质的着火点不可能改变,故D错误;
故选A;
点评 本题主要考查物质或化学用语的分类、性质及应用的知识,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 体积大小:③>②>① | B. | 原子数目:③>①>② | C. | 密度大小:②>③>① | D. | 质量大小:②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
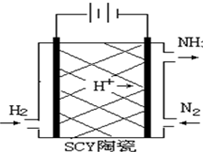 科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.
科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
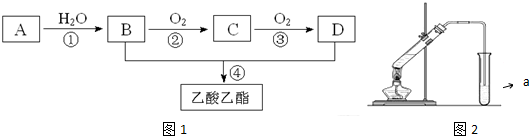
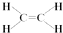 ,C的结构简式:CH3CHO.
,C的结构简式:CH3CHO.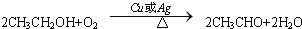 ;反应类型:氧化反应.
;反应类型:氧化反应.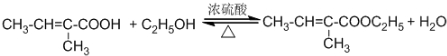 ,为从该实验后的混合气体中分离出乙酸乙酯,右侧试管中所选用的试剂a是饱和碳酸钠溶液,a试剂的作用是中和乙酸、吸收乙醇、降低乙酸乙酯在溶液中的溶解度,有利于分层析出.
,为从该实验后的混合气体中分离出乙酸乙酯,右侧试管中所选用的试剂a是饱和碳酸钠溶液,a试剂的作用是中和乙酸、吸收乙醇、降低乙酸乙酯在溶液中的溶解度,有利于分层析出.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+CO2(g)?
(g)+CO2(g)?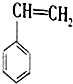 (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H| 化学键 | C-H | C-C | C=C | C=O | CO | O-H |
| 键能/kJ/mol | 413 | 348 | 615 | 745 | 1076 | 463 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com