
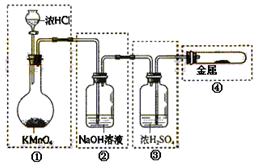
| A.只有①和②处 |
| B.只有②处 |
| C.只有②和③处 |
| D.只有②、③、④处 |
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源:不详 题型:实验题
 气进行吸收处理。
气进行吸收处理。 4+H2O中的还原剂为_______________
4+H2O中的还原剂为_______________ _.
_. 、OH
、OH 和SO
和SO .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响). 2-也不存在ClO
2-也不存在ClO ;
; L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.| 实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
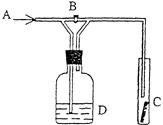
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 _______。水的沸点比硫化氢高,其原因是___________________。
_______。水的沸点比硫化氢高,其原因是___________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH3与HCl气体或CO2气体均不能共存 |
| B.铵盐溶液与NaOH 溶液混合后均会有NH3逸出 |
| C.SiO2能溶解在NaOH 溶液但不能溶解在氨水中 |
| D.硅、二氧化硅、硅酸、铵盐对热均很稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com