
【题目】下列分子或离子中,价层电子对互斥模型(简称VSEPR模型),VSEPR模型几何构型与分子或离子的立体构型不一致的是( )
A. CO2B. H2OC. CO32﹣D. CCl4
【答案】B
【解析】
价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数。σ键个数=配原子个数,孤电子对个数=![]() ×(a﹣xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型。价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;价层电子对个数为3,不含孤电子对,平面三角形结构;含有一个孤电子对,空间构型为为V形结构;价层电子对个数是2且不含孤电子对,为直线形结构,据此判断。
×(a﹣xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型。价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;价层电子对个数为3,不含孤电子对,平面三角形结构;含有一个孤电子对,空间构型为为V形结构;价层电子对个数是2且不含孤电子对,为直线形结构,据此判断。
A.CO2分子中每个O原子和C原子形成两个共用电子对,所以C原子价层电子对个数是2,且不含孤电子对,为直线形结构,VSEPR模型与分子立体结构模型一致,A不符合题意;
B.水分子中价层电子对个数=2+![]() ×(6﹣2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,B符合题意;
×(6﹣2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,B符合题意;
C.CO32﹣的中心原子C原子上含有3个σ键,中心原子上的孤电子对数=![]() ×(4+2-2×3)=0,所以CO32﹣的空间构型是平面三角形,VSEPR模型与分子立体结构模型一致,C不符合题意;
×(4+2-2×3)=0,所以CO32﹣的空间构型是平面三角形,VSEPR模型与分子立体结构模型一致,C不符合题意;
D.CCl4分子中中心原子C原子原子价层电子对个数=σ键个数+孤电子对个数=4+![]() (4﹣1×4)=4,VSEPR模型为正四面体结构,中心原子不含有孤电子对,分子构型为正四面体结构,VSEPR模型与分子立体结构模型一致,D不符合题意;
(4﹣1×4)=4,VSEPR模型为正四面体结构,中心原子不含有孤电子对,分子构型为正四面体结构,VSEPR模型与分子立体结构模型一致,D不符合题意;
故合理选项为B。


科目:高中化学 来源: 题型:
【题目】近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展。
(1)写出工业上冶炼金属镁的化学方程式______________________________________。
(2)某研究性小组探究以镁条、铝片为电极,稀氢氧化钠溶液为电解质溶液构成的原电池(如图所示),刚开始时发现电表指针向左偏转,镁条作负极;但随后很快指针向右偏转。
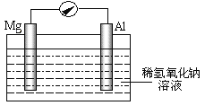
①开始阶段,镁条发生的电极反应式为_________,指出其反应类型为_________(填“氧化”或“还原”)。
②随后阶段,铝片发生的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CaCO3质量分数为0.90的石灰石100 kg完全分解产生CO2________L(标准状况),石灰窑中该石灰石100 kg与焦炭焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的质量为__________g
(2)在25℃、101kPa的条件下,同质量的CH4和X气体的体积之比为15:8,则X的摩尔质量是_______________。
(3)两个相同体积的密闭容器X、Y,在25℃下,X中充入a gA气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1个氧气分子体积为 ![]() cm3
cm3
B.铜电解精炼时,当阳极质量减少64 g时,电路中转移电子数为2NA
C.标准状况下22.4 L Cl2完全溶于水时,所得溶液中含氯微粒总数为2NA
D.NaCl晶体中Na+与最近Cl-的核间距离为a cm,则其晶体密度为 ![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是体心立方堆积,关于钠晶体,下列判断合理的是 ( )
A. 其熔点比金属铝的熔点高
B. 一个钠的晶胞中,平均含有4个钠原子
C. 该晶体中的自由电子在外加电场作用下可发生定向移动
D. 该晶体中的钠离子在外加电场作用下可发生定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
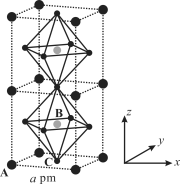
【题目】我国科学家成功合成了甲基胺离子导向的钙钛矿类杂化材料(CH3NH3)PbI3,该物质因具有较高的光电转换效率而在太阳能电池领域具有重要的应用价值。回答下列问题
(1)C、N基态原子中,第一电离能较大的是_____。
(2)CH3NH3+的电子式为_____,C、N原子的杂化轨道类型分别为______、______;CH3NH3+中,存在______(填代号)。
a.σ键 b.π键 c.配位键 d.氢键
已知甲基的供电子能力强于氢原子,则CH3NH2、(CH3)2NH中接受质子能力较强的是______。
(3)(CH3NH3)PbI3的立方晶格结构如图所示,其中B代表Pb2+,则______代表 I,每个晶胞中含有I 的数目为______。原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),B为(1/2,1/2,1/2),则C的原子分数坐标为______。已知(CH3NH3)PbI3的晶胞参数为a pm,晶体密度为 g·cm3,设NA为阿伏加德罗常数的值,则(CH3NH3)PbI3的摩尔质量为________g·mol1(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
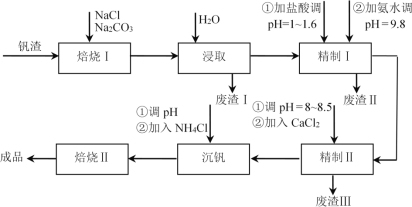
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。
②AlO![]() +4H+=Al3++2H2O。
+4H+=Al3++2H2O。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式________;废渣Ⅰ的主要成分是________;精制Ⅰ中加盐酸调pH的主要作用是________,加入NH3·H2O后发生反应的离子方程式为________。
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是________;pH过大时,沉淀量增大的原因是________。
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是________。NH4VO3在500℃时焙烧脱氨制得产品V2O5,反应方程式为2NH4VO3![]() V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com