
����Ŀ���ҹ���ѧ�ҳɹ��ϳ��˼������ӵ���ĸ��ѿ����ӻ�����(CH3NH3)PbI3������������нϸߵĹ��ת��Ч�ʶ���̫���ܵ�����������Ҫ��Ӧ�ü�ֵ���ش���������
��1��C��N��̬ԭ���У���һ�����ܽϴ����_____��
��2��CH3NH3+�ĵ���ʽΪ_____��C��Nԭ�ӵ��ӻ�������ͷֱ�Ϊ______��______��CH3NH3+�У�����______������ţ���
a������ b������ c����� d�����
��֪���Ĺ���������ǿ����ԭ�ӣ���CH3NH2��(CH3)2NH�н�������������ǿ����______��
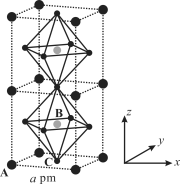
��3��(CH3NH3)PbI3����������ṹ��ͼ��ʾ������B����Pb2+����______���� I��ÿ�������к���I ����ĿΪ______��ԭ�ӷ�����������ڱ�ʾ�����ڲ���ԭ�ӵ����λ�á����У�ԭ�ӷ�������AΪ��0��0��0����BΪ��1/2��1/2��1/2������C��ԭ�ӷ�������Ϊ______����֪(CH3NH3)PbI3�ľ�������Ϊa pm�������ܶ�Ϊ g��cm3����NAΪ�����ӵ�������ֵ����(CH3NH3)PbI3��Ħ������Ϊ________g��mol1���ô���ʽ��ʾ����
���𰸡�N 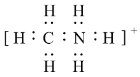 sp3 sp3 ac (CH3)2NH C 3 ��
sp3 sp3 ac (CH3)2NH C 3 ��![]() ��
��![]() ��0�� ��a3NA��10��30
��0�� ��a3NA��10��30
��������
��1��C��N�����ڵڶ����ڣ���һ��������������������N�ĵ�һ������ǿ��C���ʴ�Ϊ��N��
��2��CH3NH3+����ʽΪ��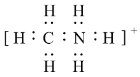 ��Cԭ�Ӻ���4�����������ӻ����Ϊsp3��Nԭ�Ӻ���4�����������ӻ����Ϊsp3�� ��CH3NH3+����ʽ��֪C��H��N��H֮�������������������N�ṩ�µ��Ӷԣ�H���пչ�������γ���λ�������Ĺ���������ǿ����ԭ�ӣ���CH3)2NH�к�����������������������ǿ���ʴ�Ϊ��
��Cԭ�Ӻ���4�����������ӻ����Ϊsp3��Nԭ�Ӻ���4�����������ӻ����Ϊsp3�� ��CH3NH3+����ʽ��֪C��H��N��H֮�������������������N�ṩ�µ��Ӷԣ�H���пչ�������γ���λ�������Ĺ���������ǿ����ԭ�ӣ���CH3)2NH�к�����������������������ǿ���ʴ�Ϊ��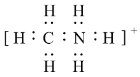 ��sp3��sp3��ac��(CH3)2NH��
��sp3��sp3��ac��(CH3)2NH��
��3��������A����ĿΪ![]() ��B����ĿΪ1��C����ĿΪ��
��B����ĿΪ1��C����ĿΪ��![]() ��B����Pb2+���ɻ�ѧʽ��֪(CH3NH3)PbI3 ��Pb2+��I����֮��Ϊ1:3����C����I������Ϊ3��ԭ�ӷ�������AΪ��0��0��0����BΪ��1/2��1/2��1/2������C��ԭ�ӷ�������Ϊ��
��B����Pb2+���ɻ�ѧʽ��֪(CH3NH3)PbI3 ��Pb2+��I����֮��Ϊ1:3����C����I������Ϊ3��ԭ�ӷ�������AΪ��0��0��0����BΪ��1/2��1/2��1/2������C��ԭ�ӷ�������Ϊ��![]() ��
��![]() ��0������������Ϊ
��0������������Ϊ![]() ���������Ϊ
���������Ϊ![]() �������ܶ�Ϊ
�������ܶ�Ϊ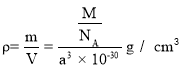 ����Ħ������Ϊ��a3NA��10��30���ʴ�Ϊ��C��3����
����Ħ������Ϊ��a3NA��10��30���ʴ�Ϊ��C��3����![]() ��
��![]() ��0������a3NA��10��30��
��0������a3NA��10��30��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A������ʯ�͵���Ҫ�л�����ԭ�ϣ�E�Ǿ��й���ζ���л��F��һ�ָ߾�����Ƴɶ��ְ�װ���ϡ�������ͼת����ϵ������и��⣺

��1��A�ķ���ʽ��___________��C��������____________��F�Ľṹ��ʽ��____________��
��2��D�����еĹ�����������________________�������һ����ʵ������֤D���ʴ��ڸù����ţ��䷽����_________________________________________________________��
��3��д����Ӧ�ڡ��۵Ļ�ѧ����ʽ��ָ���۵ķ�Ӧ���ͣ�
��Ӧ�ڣ�___________________________________����Ӧ�ۣ�___________________________________����Ӧ������___________��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�ֿ�ű��ҩ��о�������ҩ�������״����2019-nCOV�нϺ��������ã������Ǹ�ҩ��������୵ĺϳ�·�ߡ�
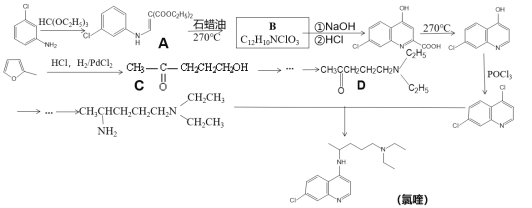
��֪����![]() ���з����ԣ�
���з����ԣ�
��R1-Cl+H2N-R2 �� R1-NH-R2+HCl
��ش�
��1������˵������ȷ����_________
A.����������� B.��୵ķ���ʽΪC18H24N3Cl
C.�����ϳɹ����а�����ȡ�����ӳɷ�Ӧ D.1molB����������3molNaOH
��2����д��Aת����B�Ļ�ѧ����ʽ_________
��3��Aת����B�Ĺ����л�������һ��˫��Ԫ���������ṹ��ʽΪ_________
��4����������ϩΪԭ�Ͻ��ϳ�·����C��D���ֲ�������������·ͼ��ʾ���������Լ���ѡ��_________
��5����д����������������![]() ��ͬ���칹��_________
��ͬ���칹��_________
��1HNMR����ʾ������ֻ��������H���ڷ�����ֻ����һ�����ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Al2H6ȼ���ȼ��ߣ���һ�ֺܺõ������������ˮ��Ӧ����H2�����ģ����ͼ������ΪAl������ΪH���������Ʋ�϶�����ȷ���ǣ�������

A. ��������ˮ��Ӧ������������ԭ��Ӧ
B. Al2H6�ڿ�������ȫȼ�գ�����Ϊ��������ˮ
C. Al2H6������ ��Ϊ+1�ۣ���Ϊ��3��
D. ������������ܳ�Ϊδ���Ĵ�����Ϻͻ��ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��ӻ������У��۲���ӶԻ���ģ�ͣ����VSEPRģ�ͣ���VSEPRģ�ͼ��ι�������ӻ����ӵ����幹�Ͳ�һ�µ��ǣ�������
A. CO2B. H2OC. CO32��D. CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д���пհ� [�ڣ�1������4��С����Ԫ�ط�����д]��
��1����������ԭ�Ӱ뾶��С��Ԫ��__________��
��2����һ����������Ԫ��__________��
��3���縺������Ԫ��__________��
��4�����������е�һ��������С��Ԫ��__________��
��5������8�����ӣ�10�����ӵ�ԭ�ӵĻ�ѧ����__________��
��6�����������Ų�Ϊ4s24p1��ԭ�ӵĺ˵����Ϊ__________��
��7�����ڱ�������õķǽ���Ԫ��ԭ�ӵĵ����Ų�ͼΪ______________________________��
��8��ijԪ�غ������������Ӳ㣬�����������Ǻ������������1/6��д����Ԫ�ص����ӽṹʾ��ͼ__________��
��9��д����̬ͭԭ�ӵĵ����Ų�ʽ________________��λ��__________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I�Ǻϳɺ���Ԫ����������һ���м��塣����Robinson�ɻ���Ӧ�ϳ�I��·�����£��ش��������⣺

��֪����![]()
��
��1��B��C�ķ�Ӧ����ʽΪ________��
��2��������E��I�Ľṹ��ʽ�ֱ���________��________��
��3��C��D��F��G�ķ�Ӧ���ͷֱ���________��________��
��4��д����������������G��ͬ���칹��Ľṹ��ʽ________��
��������������ȫ��Ӧʱ���������ʵ���֮��Ϊ1:3������4�ֲ�ͬ��ѧ�������⡣
��5��д���Լ״��������ᡢ���������![]() Ϊԭ�Ϻϳ�
Ϊԭ�Ϻϳ� �ĺϳ�·�ߣ������Լ���ѡ����______________________________________��
�ĺϳ�·�ߣ������Լ���ѡ����______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��373KʱN2��H2��Ӧ�����������仯������ͼ������������ȷ���� �� ��
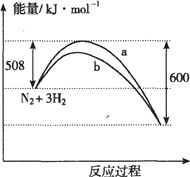
A. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2![]() 2NH3 ��H=��92kJ��mol��1
2NH3 ��H=��92kJ��mol��1
B. ����������û�ѧ��Ӧ�ķ�Ӧ�Ȳ���
C. a�����Ǽ������ʱ�������仯����
D. ���¶����һ���������£�ͨ��1mol N2��3 mol H2��Ӧ��ų�������ΪQ1kJ����Q1=92
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬ��Ba(OH)2��Һ�У��ֱ�������ʵ���Ũ����ȵ�H2SO4��NaHSO4��Һ���䵼�������������Һ����仯��������ͼ��ʾ��
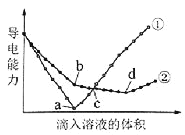
���з�������ȷ����( )
A.�ٴ����μ�H2SO4��Һ�ı仯����
B.b�㣬��Һ�д������ڵ�������Na+��OH�C
C.c�㣬����Һ�к�����ͬ����OH�C
D.a��d�����Ӧ����Һ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com