

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
分析 通过氮气将装置中空气排出,防止TiCl4被氧化,A为干燥管,干燥氮气,防止生成的TiCl4遇潮湿的气体产生白雾;B装置加热使四氯化碳挥发,C中装置在加热条件下,发生反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,E装置连接空气,盛放浓硫酸,干燥空气,
(1)根据仪器的特征及常见仪器的名称解答;
(2)对于气体的制取性质实验应该:组装仪器、检验气密性、加装药品,发生反应,终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2;D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,分离互溶的液体采取蒸馏方法;
(3)由于TiCl4遇潮湿空气产生白雾,发生水解反应,且反应在无氧条件下进行,故E装置作用是防止空气中水蒸气、氧气进入;A装置不能吸收空气中的氧气;
(4)根据钛是一种耐强酸强碱的金属,而硅能溶于碱生成硅酸盐,硅酸盐和酸生成硅酸沉淀,据此分析设计检验实验方案;
(5)根据反应物和生成物结合质量守恒定律来书写化学方程式;
(6)TiO2•xH2O的表面有氯离子杂质,所以检验沉淀是否洗涤干净的方法是检验洗涤滤液中是否含有氯离子;
(7)①铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制NH4Fe(SO4)2水解;
②用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3;
③根据转移电子数相等计算二氧化钛的质量,再根据质量分数公式进行计算.
解答 解:通过氮气将装置中空气排出,防止TiCl4被氧化,A为干燥管,干燥氮气,防止生成的TiCl4遇潮湿的气体产生白雾;B装置加热使四氯化碳挥发,C中装置在加热条件下,发生反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,E装置连接空气,盛放浓硫酸,干燥空气.
(1)仪器A呈球形,在该实验中用于干燥氮气,为球形干燥管,
故答案为:球形干燥管;
(2)对于气体的制取性质实验应该:组装仪器、检验气密性、加装药品,发生反应,终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2,正确的操作顺序是②①④③⑤⑦⑥,D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,但CCl4和TiCl4是两种沸点差异较大的液体混合物,应该用蒸馏进行分离,
故答案为:②①④③⑤⑦⑥;蒸馏 (或分馏);
(3)由于TiCl4遇潮湿空气产生白雾,发生水解反应,且反应在无氧条件下进行,故E装置作用是防止空气中水蒸气、氧气进入;A装置可以吸收水,但不能不能吸收空气中的氧气,不能保证反应在无氧环境下进,故E装置不能换成A装置;
故答案为:不能;装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行;
(4)钛是一种耐强酸强碱的金属,而硅能溶于碱生成硅酸盐,取少量合金样品于试管中,滴加过量NaOH溶液,振荡,Si+2NaOH+H2O=Na2SiO3+2H2↑,静置后取上层清液,再逐滴滴入稀盐酸至过量,Na2SiO3+2HCl=H2SiO3↓+2NaCl,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si,
故答案为:取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si;
(5)TiCl4水解生成TiO2•xH2O,设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(x+2),所以化学方程式为:TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl,
故答案为:TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl;
(6)TiO2•xH2O的表面有氯离子杂质,所以检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中加入硝酸酸化的AgNO3若没有产生沉淀,则已洗干净,
故答案为:取最后一次洗涤液于试管中加入硝酸酸化的AgNO3若没有产生沉淀,则已洗干净;
(7)①铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制NH4Fe(SO4)2水解,
故答案为:抑制NH4Fe(SO4)2水解;
②因为KSCN作指示剂时,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3,所以用KSCN作指示剂,
故答案为:KSCN溶液;
③根据氧化还原反应中得失电子相等得二者的关系式,TiO2~NH4Fe(SO4)2,二氧化钛的质量=$\frac{0.1mol/L×0.02L×1}{1}$g/mol=0.16g,TiO2试样0.2g,其质量分数=$\frac{0.16g}{0.2g}$=80%,
故答案为:80%.
点评 本题考查实验制备方案以及测定TiO2的质量分数实验方案,明确原理是解题关键,侧重考查学生装置的分析评价,注意对题目信息的提取与应用,是对学生综合能力的考查,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO | |
| B. | 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- | |
| C. | NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| D. | 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
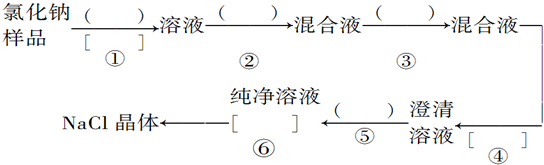
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
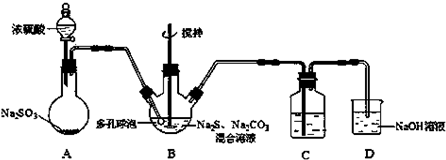
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
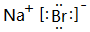 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
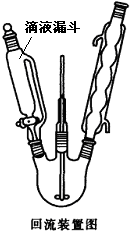 间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com