
【题目】由反应物X转化为Y和Z的能量变化如图所示。下列说法错误的是( )
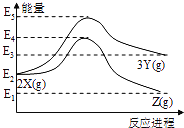
A. 由![]() 反应的ΔH >0
反应的ΔH >0
B. 由![]() 反应的ΔH = (E2-E1) kJ/mol
反应的ΔH = (E2-E1) kJ/mol
C. 降低压强有利于提高Y的产率
D. 降低温度有利于提高Z的产率
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的![]() ,模拟装置如图所示。下列说法正确的是
,模拟装置如图所示。下列说法正确的是

A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为4OH4e![]() 2H2O+O2↑
2H2O+O2↑
C.电解一段时间后,阴极室溶液中的pH升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:

Ⅰ.①若烧杯中溶液为稀硫酸,则观察到的现象是 ,负极反应式为 。
②若烧杯中溶液为氢氧化钠溶液,则负极为 (填“Mg”或“Al”),总反应的化学方程式为 。
Ⅱ.中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为 ,c口通入的物质为 。
②该电池负极的电极反应式为 。
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有 NA个电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100 mL CuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。
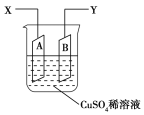
(1)当以I A的电流电解6 min后,测得铜片A质量减少2.56 g,则图装置中的X端应与直流电的________极相连。
(2)电解后将电源反接,2I A的电流电解6 min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1 mol/L,则原溶液中CuSO4物质的量浓度________mol/L。溶液中H+的物质的量浓度为________mol/L。
(3)列式计算实验测得阿伏加德罗常数NA(用I表示)________mol-1。(已知电子电量e=1.60×10-19 C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 为固体物质,实验室利用
为固体物质,实验室利用![]() 与水反应制备气态物质
与水反应制备气态物质![]() 。各物质间的转化关系如下图所示:
。各物质间的转化关系如下图所示:
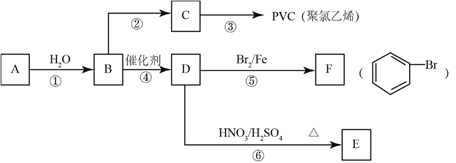
(1)写出下列反应的化学方程式:
步骤①____________________________________________________;
步骤⑥____________________________________________________反应类型____________;
步骤④____________________________________________________反应类型____________;
(2)有关下述物质正确的是________________________。
A.物质![]() 、
、![]() 都属于不饱和卤代烃
都属于不饱和卤代烃
B.物质![]() 、
、![]() 、
、![]() 都可以与溴水发生化学反应而使溴水褪色
都可以与溴水发生化学反应而使溴水褪色
C.物质![]() 、
、![]() 、
、![]() (聚氯乙烯)都可以使酸性高锰酸钾溶液褪色
(聚氯乙烯)都可以使酸性高锰酸钾溶液褪色
D.物质![]() 、
、![]() 、
、![]() 一定条件下都可以与
一定条件下都可以与![]() 发生加成反应,等物质的量的
发生加成反应,等物质的量的![]() 、
、![]() 、
、![]() 完全加成消耗
完全加成消耗![]() 物质的量相同
物质的量相同
(3)已知![]() 与
与![]() 为同系物,分子式为
为同系物,分子式为![]() 。若
。若![]() 苯环上的一氯代物有三种,写出
苯环上的一氯代物有三种,写出![]() 所有可能的结构简式____________________________________。
所有可能的结构简式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )
N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )

A. 前10 min内,用v(NO2)表示的反应速率为0.04 mol·L-1·min-1
B. 反应进行到10 min时,体系放出的热量为9.68 kJ
C. a点正反应速率小于逆反应速率
D. 25 min时,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或实验仪器使用正确的是
A.将高锰酸钾溶液盛装在碱式滴定管中
B.容量瓶、滴定管使用前均需用蒸馏水洗净并烘干
C.用10 mL量筒量取2.5 mL浓硫酸用于配制一定浓度的稀硫酸
D.溶液蒸发浓缩时,用坩埚钳夹持蒸发皿直接加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g) + 2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) △H2
CH3OH(g) + H2O(g) △H2
③CO2(g) + H2(g)![]() CO(g) + H2O(g) △H3
CO(g) + H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=_____kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=_______kJ·mol-1
(2)反应①的化学平衡常数K的表达式为_____;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母)。
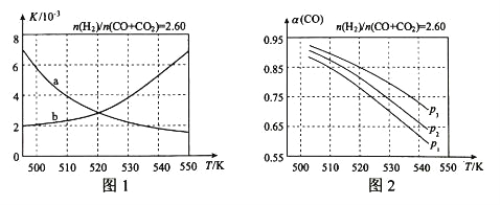
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α与温度和压强的关系如图2所示。 α(CO)值随温度升高而_______(填“增大”或“减小”)。图2中的压强由大到小为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器里进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如图所示: 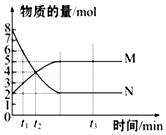
(1)此反应的化学方程式中a:b=
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为
(3)t1时N的转化率为:
(4)下列①→⑩的说法中可以证明 H2(g)+I2(g)2HI(g)已达平衡状态的是: ①单位时间内生成n molH2 的同时生成n mol HI
②一个H﹣H 键断裂的同时有两个H﹣I键断裂
③质量分数:w(HI)=w(I2)
④容器内HI(g)、H2 (g)、I2 (g)共存
⑤c(HI):c(H2):c(I2)=2:1:1
⑥温度和体积一定时,容器内压强不再变化
⑦温度和体积一定时,HI(g)浓度不再变化
⑧温度和压强一定时,混合气体的平均摩尔质量不再变化
⑨温度和压强一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再变化.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com