
【题目】下列图示与对应的叙述相符的是( )
甲 乙 丙 丁
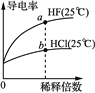
A. 由图甲可知,a点Kw的数值比b点Kw的数值大
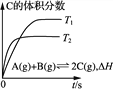
B. 乙表示在相同的密闭容器中,不同温度下的反应,该反应的ΔH<0
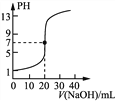
C. 丙表示0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1醋酸溶液的滴定曲线
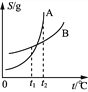
D. 丁表示A、B两物质的溶解度随温度变化情况,将t1 ℃时A、B的饱和溶液分别升温至t2 ℃时,溶质的质量分数ω(A)>ω(B)
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。

(1)该物质的结构简式为___________________。
(2)该物质中所含官能团的名称为_____________________。
(3)下列物质中,与该产品互为同系物的是__________________,与该产品互为同分异构体的是__________________。(填序号)
①CH3CH="==CHCOOH"
②CH2===CHCOOCH3
③CH3CH2CH===CHCOOH
④CH3CH(CH3)COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素。X与W可形成四面体形的共价化合物,该化合物常用作灭火剂。Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y、Z的最外层电子数之和等于W的最外层电子数。
(1)用化学符号表示X的一种核素 。
(2)写出Y的单质与X的最高价氧化物反应的化学方程式 。
(3)Z的单质在W的单质中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构的分子为 。
(4)用电子式表示Y与W形成化合物的过程为 。
(5)XW4的电子式为 。
(6)W的氢化物R是实验室一种常用试剂的主要成分,该试剂可用于实验室多种气体的制备,写出实验室制取气体时满足下列条件的离子方程式。
①R作氧化剂: 。
②R作还原剂: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述中,不正确的是( )
A.植物油能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生水解反应
D.蛋白质遇硫酸铜溶液后会变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中利用CoCl2·6H2O为原料制取三氯化六氨合钴的实验步骤如下:
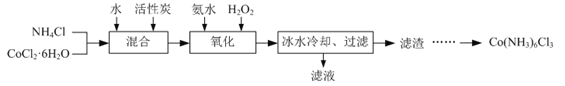
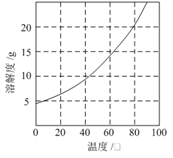
已知:①Co(NH3)6Cl3在不同温度下水中的溶解度曲线如右图。
②在Co(NH3)6Cl3溶液中加入一定量盐酸有利于结晶。
③Ksp=1.09×10-15,Ksp=2×10-44。
⑴在实验过程中NH4Cl除作反应物外,还可防止在滴加氨水时c(OH-)过大,其原理是___________。
⑵氧化过程中加入氨水和H2O2在溶液中生成Co(NH3)6Cl3。
①氧化时须先加入氨水再加入H2O2,其原因是___________。
②该反应的化学方程式为___________。
③反应时需要控制反应温度在50 ℃~60 ℃之间,可采取的加热方式是___________。
⑶冰水冷却的目的是___________。
⑷请补充完整由过滤后所得滤渣获取Co(NH3)6Cl3的实验方案:将滤渣加入沸水中,充分搅拌,
___________,低温干燥。(实验中须使用的试剂:盐酸、乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3溶液和Fe(OH)3胶体共同具备的性质是( )
A.加入饱和NaCl溶液都产生沉淀 B.加入盐酸先产生沉淀,然后沉淀溶解
C.都能产生丁达尔效应 D.分散质的粒子都能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:

流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1) 为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:
①适当升高温度;②搅拌;③________等。
(2) 加入H2O2时发生主要反应的离子方程式为________________。
(3) “除铁”时,控制溶液pH的范围为______________。
(4) 滤渣B的主要成分的化学式为______________。
(5) 已知:Ksp(NiCO3)=1.42×10-7。为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>________mol·L-1。
(6) “氧化”生成Ni2O3的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于制备氢氧化铁胶体的正确操作方法是
A. 在氯化铁溶液中滴入氢氧化钠溶液 B. 加热煮沸氯化铁溶液
C. 把氯化铁溶液滴入热水中 D. 把饱和的氯化铁溶液逐滴滴入到沸水中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com