
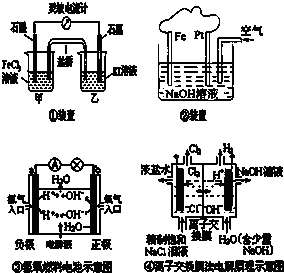
| A、①装置的总反应为2Fe3+2I-═2Fe2++I2 |
| B、②装置中Fe为阴极,电极反应为 Fe-2e-+2OH-═Fe(OH)2 |
| C、③装置中外电路电子由b极流向a极 |
| D、④装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L氯仿中含有C-Cl键的键数为1.5NA |
| B、常温下,42g丁烯和环丙烷的混合气体中含有σ键的数目为3NA |
| C、常温下,1mol SiC中含有Si-C键的数目为4NA |
| D、常温常压下,17g甲基(-14CH3)所含的中子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16.7% | B、50% |
| C、66.7% | D、83.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0﹒5mo1C2H4 |
| B、11﹒2L(标准状况)C2H2 |
| C、含6﹒02×1023个氢原子的CH4 |
| D、18g H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 溴水 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 乙醇(乙酸) | 无 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、纯碱、碳酸氢钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、用丁达尔效应区别FeCl3溶液和Fe(OH)3胶体 |
| C、生石灰与水混合的过程只发生物理变化 |
| D、H2O、HCOOH、Cu(NH3)4SO4均含有氧,都是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、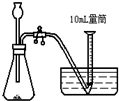 |
B、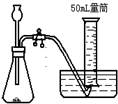 |
C、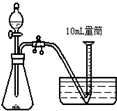 |
D、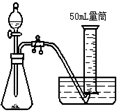 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com