
| A. | 在c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- | |
| B. | pH<7的溶液中:SO42-、CO32-、Na+、K+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
分析 A.在c(H+)=1.0×10-13 mol•L-1的溶液,为碱溶液;
B.pH<7的溶液,显酸性;
C.离子之间发生氧化还原反应;
D.pH=1的溶液,显酸性,离子之间发生氧化还原反应.
解答 解:A.在c(H+)=1.0×10-13 mol•L-1的溶液,为碱溶液,该组离子之间不反应,可大量共存,故A正确;
B.pH<7的溶液,显酸性,不能大量存在CO32-,故B错误;
C.H+、Fe2+、NO3-发生氧化还原反应,不能共存,故C错误;
D.pH=1的溶液,显酸性,H+、ClO-、Cl-发生氧化还原反应,不能共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:填空题
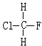 与
与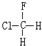 B.
B.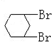 与
与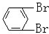 C.
C.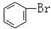 与
与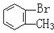 D.
D.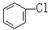 与
与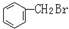 E.ClC(CH3)3与(CH3)2CHCH2Cl F.
E.ClC(CH3)3与(CH3)2CHCH2Cl F.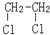 与CH3-CH2Cl.
与CH3-CH2Cl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
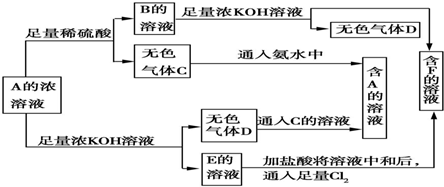
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
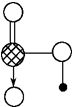
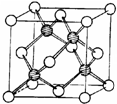 ?
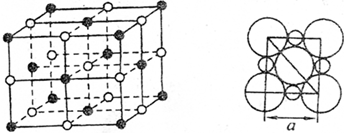
?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
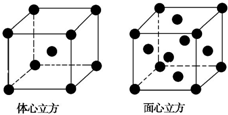 氮族元素是指位于元素周期表第15列的元素,包括氮、磷、砷(As)、锑(Sb)、铋(Bi)五种元素.请回答下列问题:
氮族元素是指位于元素周期表第15列的元素,包括氮、磷、砷(As)、锑(Sb)、铋(Bi)五种元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Mg2+ | C. | Fe3+ | D. | Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com