
分析 (1)先计算NaCl溶液中溶质的质量分数,阳极上生成氯气,根据Cl原子守恒计算m(NaCl),从而计算溶液质量;
(2)电解后溶液中溶质为NaOH,根据Na原子守恒计算n(NaOH)=n(NaCl),电解时阳极上生成氯气、阴极上生成氢气,所以相当于析出HCl,根据氯原子守恒得n(HCl)=n(NaCl),则析出气体质量=m(HCl),溶液体积=$\frac{溶液质量}{溶液密度}$,电解后c(NaOH)=$\frac{n}{V}$;
(3)根据(2)知,电解后析出的物质相当于HCl,要使电解后溶液恢复原状,需要通入适量HCl即可.
解答 解:(1)该温度下的饱和溶液的质量分数=$\frac{36g}{136g}$×100%=$\frac{9}{34}$,用惰性电极进行电解饱和氯化钠溶液,阳极上生成氯气,n(Cl2)=$\frac{11.2L}{22.4L/mol}$=0.5mol气体(标准状况)时,根据Cl原子守恒得n(NaCl)=2n(Cl2)=2×0.5mol=1mol,m(NaCl)=1mol×58.5g/mol=58.5g,
则饱和食盐水的质量=$\frac{58.5g}{\frac{9}{34}}$=221g,
答:电解时,所取饱和食盐水的质量是221g;
(2)电解后溶液中溶质为NaOH,根据Na原子守恒计算n(NaOH)=n(NaCl)=1mol,电解时阳极上生成氯气、阴极上生成氢气,所以相当于析出HCl,根据氯原子守恒得n(HCl)=n(NaCl)=1mol,则析出气体质量=m(HCl)=1mol×36.5g/mol=36.5g,溶液质量=221g-36.5g=184.5g,溶液体积=$\frac{溶液质量}{溶液密度}$=$\frac{184.5g}{1.23g/mL}$=150mL=0.15L,电解后c(NaOH)=$\frac{n}{V}$=$\frac{1mol}{0.15L}$=6.67mol/L;
答:电解后溶液中NaOH的物质的量浓度为6.67mol/L;
(3)根据(2)知,电解后析出的物质相当于HCl,要使电解后溶液恢复原状,需要通入析出的HCl即可
,析出HCl的物质的量是1mol,质量是36.5g,所以需要通入36.5gHCl即可,
答:要使溶液恢复到原状态,需加入HCl气体,其质量是36.5g.
点评 本题以电解原理为载体考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确溶液中溶质、析出物质成分及各个物理量之间的关系式是解本题关键,注意原子守恒的灵活运用,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
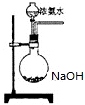 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.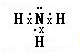 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有甲烷 | B. | 一定含有乙烯 | ||
| C. | 可能是乙烷和甲烷的混合气体 | D. | 一定含有乙烯,不一定含有甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- | |
| B. | pH<7的溶液中:SO42-、CO32-、Na+、K+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可使溴的四氯化碳溶液褪色 | B. | 乙醇难溶于水,密度比水小 | ||
| C. | 氧化镁用于电解冶炼单质镁 | D. | 二氧化硅用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com