
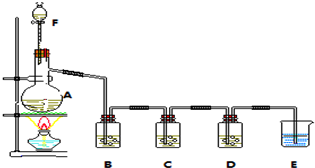
分析 Ⅰ.(1)根据氧气A的构造可知其名称为蒸馏烧瓶;装置中有残留氯气,E是吸收过量的气体防止污染环境;
(2)D装置盛放的是硝酸银溶液,用于判断氯气是否过量,当D中有白色沉淀生成时,则氯气已经过量,应该停止加热;
(3)氯气和水反应生成盐酸和次氯酸,是化学平衡,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,氯化氢极易溶于水;
Ⅱ.(1)I-和IOX-在酸性条件下反应生成碘单质,根据化合价变化配平该反应的离子方程式;
(2)根据消耗的硫代硫酸钠的物质的量及反应方程式计算出生成碘单质的物质的量,结合方程式计算出消耗碘酸根离子的物质的量;根据原C溶液中碘化钾的浓度可知生成碘酸根离子浓度,从而得出x;理论上x应该为3,根据计算结果判断偏高还是偏低,并分析造成该结果的原因;通过加热的方法可以刚走装置中氯气.
解答 解:Ⅰ.(1)根据图示可知,A的名称为蒸馏烧瓶,装置中有残留氯气有毒,E中溶液是吸收过量的氯气,防止污染环境,
故答案为:蒸馏烧瓶; 吸收多余氯气,防止污染空气;
(2)当氯气过量时,装置D中硝酸银溶液会变浑浊,所以当D中出现浑浊(或有白色沉淀)时,停止加热,
故答案为:浑浊(或有白色沉淀);
(3)氯气和水反应生成盐酸和次氯酸,是化学平衡,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,氯化氢极易溶于水,平衡原理解释B装置的作用是,氯气在水中的溶解平衡为:Cl2+H2O?H++Cl-+HClO,饱和食盐水中C(CI-)很大,可以抑制氯气的溶解,而氯化氢又极易溶于水,因此采用饱和食盐水既能除去HCI又能避免因溶解而造成CI2的损失,
故答案为:氯气在水中的溶解平衡为:Cl2+H2O?H++Cl-+HClO,饱和食盐水中C(CI-)很大,可以抑制氯气的溶解,而氯化氢又极易溶于水,因此采用饱和食盐水既能除去HCI又能避免因溶解而造成CI2的损失;
Ⅱ.(1)I-和IOX-在酸性条件下反应生成碘单质,IOX-中碘元素的化合价为(2x-1)价,反应后变为0价,化合价变化为(2x-1),碘离子的化合价为-1,反应后变为0价,化合价变化为1,则碘离子的系数为(2x-1),IOX-的系数为1,然后根据质量守恒配平可得:(2x-1)I-+IOX-+2xH+=xI2+xH2O,
故答案为:(2x-1)I-+IOX-+2xH+=xI2+xH2O;
(2)0.5000mol/L的Na2S2O3溶液滴定至蓝色刚好褪去,耗Na2S2O3溶液25.20mL,消耗硫代硫酸钠的物质的量为:0.5000mol/L×0.0252L=0.0126mol,根据反应I2+2S2O32-=2I-+S4O62-可知,消耗碘单质的物质的量为:0.0126mol×$\frac{1}{2}$=0.0063mol,
原C中KI的浓度为0.1000mol/L,根据质量守恒,反应后生成IOX-的浓度也是0.1000mol/L,则20mL该溶液中含有IOX-的物质的量为:0.1000mol/L×0.02L=0.002mol,根据反应:(2x-1)I-+IOX-+2xH+=xI2+xH2O可知0.002molIOX-完全反应生成碘单质的物质的量为:0.002mol×x=0.0063mol,解得:x=3.15;理论上x应该为3,所以比理论值偏高;可能是装置C中有残余氯气,会氧化KI生成I2,导致x偏高,装置C反应后的溶液中含有氯气会影响测定结果,可加热煮沸所取的20.00mL液体,赶走溶在其中的氯气,
故答案为:3.15; C中有残余氯气,会氧化KI生成I2;加热煮沸所取的20.00mL液体,赶走溶在其中的氯气.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的及实验原理为解答关键,试题侧重考查学生的分析、理解能力及逻辑推理能力,注意掌握物质性质实验方案设计与评价原则.


科目:高中化学 来源: 题型:选择题
| A. | 在反应中不一定所有元素的化合价都发生变化 | |
| B. | 肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 非金属单质在反应中只做氧化剂 | |
| D. | 某元素从化合物变为单质时,该元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0、△S<0 | B. | △H>0、△S>0 | C. | △H<0、△S<0 | D. | △H<0、△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.
新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 取少量反应后的黑色粉末X,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;产生少量气泡 |
| Ⅱ | 向实验I中得到的溶液滴加2滴KSCN溶液,振荡 | 溶液没有出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第1次 | 20.00 | 4.10 | 29.10 |
| 第2次 | 20.00 | 0.00 | 24.90 |
| 第3次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液的体积(mL) | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积(mL) | ||
| 第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com