
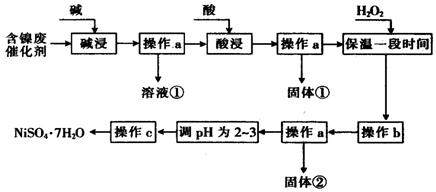
 新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.
新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 取少量反应后的黑色粉末X,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;产生少量气泡 |
| Ⅱ | 向实验I中得到的溶液滴加2滴KSCN溶液,振荡 | 溶液没有出现红色 |
分析 [探究一]加热温度较低,应生成FeO和氢气;
[探究二]用酒精喷灯加热,温度较高,可生成四氧化三铁和氢气,装置中试管a用于提供水蒸气,点燃氢气时应先验纯,防止爆炸;
[探究三]生成气体为氢气,说明铁粉过量,则溶液中不存在铁离子,加入KSCN溶液不显红色;
【探究反思】根据铁粉的质量和生成物的质量,确定反应后固体中铁的质量,结合2Fe3++Fe=3Fe2+确定氯化铁的物质的量.
解答 解:(1)加热试管使湿棉花中的水蒸发,湿棉花主要是提供反应物水蒸气,与铁粉发生反应,因加热温度较低,应生成FeO和氢气,方程式为,
故答案为:提供水蒸气作为反应物;Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
(2)有气体参加反应,则实验时应先检验装置的气密性,装置中试管a用于提供水蒸气,试管a中的物质是水;
故答案为:检查气密性;水;
(3)用酒精喷灯加热,温度较高,可生成四氧化三铁和氢气,点燃氢气时应先验纯,防止爆炸,
故答案为:氢气;验纯;
(4)生成气体为氢气,说明铁粉过量,则溶液中不存在铁离子,加入KSCN溶液不显红色,则不能确定是否含有Fe3O4,因发生2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(5)乙同学称取5.60gFe粉,用右图的装置反应一段时候后,停止加热.在干燥器中冷却后,称得6.88g,增加的质量为氧元素的质量,即n(O)=$\frac{6.88g-5.60g}{16g/mol}$=0.08mol,根据关系式Fe3O4~4O~3Fe计算,消耗0.06molFe,即剩余0.04mol铁与氯化铁反应,则由2Fe3++Fe=3Fe2+可知消耗0.08mol氯化铁,
故答案为:0.08.
点评 本题考查铁及其化合物的性质实验,为高考常见题型和高频考点,侧重学生的分析、实验和计算能力的考查,注意把握实验的原理、操作方法,难度中等.


科目:高中化学 来源: 题型:选择题
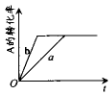 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )| A. | 增大A的浓度或减少C的浓度 | |
| B. | 缩小容器的容积或加入催化剂 | |
| C. | 升高温度或增大压强 | |
| D. | 由a变成b,A和B的物质的量与C、D的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是熵减反应 | B. | 是熵增效应大于能量效应 | ||
| C. | 是吸热反应 | D. | 是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
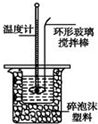 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
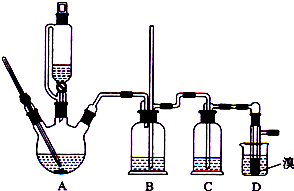
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com