
【题目】某同学在实验室进行以下实验,请将实验①②③的现象和离子反应方程式填入实验报告中. 
编号 | 现象 | 离子方程式 |
① | ||
② | ||
③ |
【答案】有红褐色沉淀生成;Fe3++3OH﹣═Fe(OH)3↓;有白色沉淀生成,溶液为蓝色;Ba2++SO42﹣═BaSO4↓;有白色沉淀生成,滴加稀硝酸,沉淀不溶解;Ag++Cl﹣═AgCl↓
【解析】解:①中NaOH与硫酸铁反应生成氢氧化铁和硫酸钠,观察到有红褐色沉淀生成,发生的离子反应为Fe3++3OH﹣═Fe(OH)3↓;②中氯化钡与硫酸铜反应生成硫酸钡和氯化铜,观察到有白色沉淀生成,溶液为蓝色,发生的离子反应为Ba2++SO42﹣═BaSO4↓;③中硝酸银与氯化钡反应生成AgCl和硝酸钡,观察到有白色沉淀生成,滴加稀硝酸,沉淀不溶解,发生的离子反应为Ag++Cl﹣═AgCl↓,所以答案是:
编号 | 现象 | 离子方程式 |
① | 有红褐色沉淀生成 | Fe3++3OH﹣═Fe(OH)3↓ |
② | 有白色沉淀生成,溶液为蓝色 | Ba2++SO42﹣═BaSO4↓ |
③ | 有白色沉淀生成,滴加稀硝酸,沉淀不溶解 | Ag++Cl﹣═AgCl↓ |


科目:高中化学 来源: 题型:
【题目】某同学将一块铝箔用砂纸仔细打磨,除去表面的保护膜,用坩埚钳夹住放在酒精灯火焰上加热至熔化,发现熔化的铝并不滴落,而是好像有一层膜兜着。对该现象的说法错误的是
A. 兜着液体的这层膜是氧化铝
B. 该实验说明了氧化铝的熔点高于铝的熔点
C. 铝极易与空气中的氧气反应在表面形成氧化物保护膜
D. 铝的化学性质较稳定,即使加热到熔化也不与空气中的氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若原子X的质子数为a,则X的质量数一定不为a
B.若两种元素形成的离子M2﹣和N+电子层结构相同,则离子半径M2﹣>N+
C.同周期非金属氧化物对应水化物酸性从左到右依次增强
D.由两种元素组成的化合物,若含有离子键,就没有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气与氢气反应生成氨气的平衡常数见下表:
N2+3H22NH3 | ||||
温度 | 25℃ | 200℃ | 400℃ | 600℃ |
平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
(1)工业上合成氨的温度一般控制在500℃,原因是 .
(2)在2L密闭容器中加入1mol氮气和3mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为mol/(Lmin).
(3)下列说法能表明该反应达到平衡的是 A.气体的平均分子量不再变化 B.密闭容器内的压强不再变化
C.v (N2)=2v (NH3) D.气体的密度不再变化
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是
A.使用催化剂
B.缩小容器体积
C.提高反应温度
D.移走NH3
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是 . A.溶液的pH增大 B.氨水的电离度减小 C.c(OH﹣)减小 D.c(NH4+)减小
(6)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH4+)与c(Cl﹣)比值变大的是 A. 加入固体氯化铵 B.通入少量氯化氢
C. 降低溶液温度 D.加入少量固体氢氧化钠.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的气体,用于生产多种化工产品。该技术中的化学反应为:CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH=+330kJ/mol
2H2O(g)+4CO(g) ΔH=+330kJ/mol
(1)下图表示初始投料比n(CH4):n(CO2)为1:3或1:4,CH4的转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用a1、a2表示]

①a2=__________。
②判断T1的T2的大小关系,并说明理由:__________。
(2)CH4超干重整CO2的催化转化原理示意图如下:

①过程Ⅰ,生成1mol H2时吸收123.5kJ热量,其热化学方程式是__________。
②过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是__________。
③假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是__________。(填序号)
a.过程Ⅰ和过程Ⅱ中发生了氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料![]() ,可导致过程Ⅱ中催化剂失效
,可导致过程Ⅱ中催化剂失效
【答案】 1:4 T2>T1 正反应为吸热反应,温度升高时甲烷的转化率增大 CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol 4H2+Fe3O4![]() 3Fe+4H2O ac
3Fe+4H2O ac
【解析】(1). ①.在相同条件下,投料比越小,甲烷的转化率越大,据图可知,a2>a1,故a2表示的是1:4时甲烷的转化率,故答案为:1:4;
②. 因CH4(g)+3CO2(g)![]() 2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
(2). ①.在过程I中,生成1mol H2时吸收123.5kJ热量,据图可知,其热化学方程式为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol;
②. 由过程II的转化关系来看,混合气体中的H2将Fe3O4还原为Fe,反应方程式为:4H2+Fe3O4 ![]() 3Fe+4H2O,故答案为:4H2+Fe3O4
3Fe+4H2O,故答案为:4H2+Fe3O4 ![]() 3Fe+4H2O;
3Fe+4H2O;
③. a. 两个过程都有元素化合价的改变,都发生了氧化还原反应,故a正确;b. 过程II中Fe3O4最终被还原为Fe,Fe3O4不是催化剂,故b错误;c. 若初始投料比![]() 时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。
时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。
【题型】综合题
【结束】
17
【题目】工、农业废水以及生活污水中浓度较高的![]() 会造成氮污染。工业上处理水体中
会造成氮污染。工业上处理水体中![]() 的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
(1)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
①除锈反应的离子反程式是__________。
②判断铁屑洗净的方法是__________。
(2)将KNO3溶液的pH调至2.5。从氧化还原的角度分析调低溶液pH的原因是__________。
(3)将上述处理过的足量铁屑投入(2)的溶液中。如图表示该反应过程中,体系内相关离子浓度、pH随时间变化的关系。请根据图中信息回答:

①t1时刻前该反应的离子方程式是__________。
②t2时刻后,该反应仍在进行,溶液中![]() 的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
(4)铁屑与KNO3溶液反应过程中向溶液中加入炭粉,可以增大该反应的速率,提高![]() 的去除效果,其原因是__________。
的去除效果,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:

已知:CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积常数如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 | 9.1×10-6 | 2.30×10-2 | 1.17×10-10 | 1.08×10-10 |
(1)用离子方程式表示K2Cr2O7溶液中同时存在K2CrO4的原因(将离子方程式补充完整):
![]() +__________=
+__________=![]() +__________。____________
+__________。____________
(2)向滤液1中加入BaCl2·2H2O的目的,是使![]() 从溶液中沉淀出来。
从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:__________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由:__________。
③研究温度对![]() 沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下
沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下![]() 的沉淀率
的沉淀率 ,如下图所示。
,如下图所示。

已知:BaCrO4(s) ![]() Ba2+(aq)+
Ba2+(aq)+ ![]() ΔH>0
ΔH>0
![]() 的沉淀效率随温度变化的原因是__________。
的沉淀效率随温度变化的原因是__________。
(3)向固体2中加入硫酸,回收重铬酸。
①硫酸浓度对重铬酸的回收率如下图所示。结合化学平衡移动原理,解释使用0.450mol/L的硫酸时,重铬酸的回收率明显高于使用0.225mol/L的硫酸的原因:__________。

②回收重铬酸的原理如图所示。当硫酸浓度高于0.450mol/L时,重铬酸的回收率没有明显变化,其原因是__________。

(4)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与__________有关。
【答案】 1 H2O 2 2 H+ 沉淀![]() ;调节溶液pH,使
;调节溶液pH,使![]() 转化为
转化为![]() 而沉淀 BaCrO4比CaCrO4更难溶,可以使
而沉淀 BaCrO4比CaCrO4更难溶,可以使![]() 沉淀更完全 温度升高,沉淀速率加快 c(H2SO4)增大,则c(
沉淀更完全 温度升高,沉淀速率加快 c(H2SO4)增大,则c(![]() )增大,与Ba2+生成沉淀,促进BaCrO4(s)
)增大,与Ba2+生成沉淀,促进BaCrO4(s) ![]() Ba2+(aq)+
Ba2+(aq)+ ![]() (aq)ΔH>0平衡右移,c(
(aq)ΔH>0平衡右移,c(![]() )增大;同时,c(H+)也增大,共同促进
)增大;同时,c(H+)也增大,共同促进![]() +H2O
+H2O![]()
![]() +2H+平衡左移,有利于生成更多的H2Cr2O7 BaSO4与BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其难于接触H2SO4,阻碍重铬酸生成 受到溶液pH、温度、H2SO4浓度、BaCrO4颗粒大小等影响
+2H+平衡左移,有利于生成更多的H2Cr2O7 BaSO4与BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其难于接触H2SO4,阻碍重铬酸生成 受到溶液pH、温度、H2SO4浓度、BaCrO4颗粒大小等影响
【解析】含有K2Cr2O7的废水同时含有SO42,加入适量熟石灰过滤得到的固体1为硫酸钙和滤液1,向滤液1中加入BaCl22H2O的目的是使CrO42从溶液中沉淀出来,过滤得到固体2为BaCrO4,滤液2检测CrO42含量达标,向固体2中加入硫酸,回收重铬酸,同时生成固体3为硫酸钡沉淀。
(1). K2Cr2O7溶液中同时存在K2CrO4的原因是重铬酸根离子在水溶液中存在化学平衡生成铬酸根离子和氢离子,反应的离子方程式为Cr2O72+H2O2CrO42+2H+,故答案为:1、H2O、2、2、H+;
(2). ①. 根据表中物质的溶度积常数可知,熟石灰的作用是沉淀硫酸根离子,调节溶液pH使Cr2O72转化为CrO42而沉淀,故答案为:沉淀SO42-,调节溶液pH,使Cr2O72转化为CrO42而沉淀;
②. 根据表中数据可知,BaCrO4比CaCrO4更难溶,所以选用Ba2+处理废水可以使CrO42沉淀更完全,故答案为:BaCrO4比CaCrO4更难溶,可以使CrO42沉淀更完全;
③. 根据图象可知,CrO42的沉淀率随温度升高增大,沉淀速率加快,故答案为;温度升高,沉淀速率加快;
(3). ①. c(H2SO4)增大,则c(SO42-)增大,与Ba2+生成沉淀,促使![]() Ba2+(aq)+CrO42(aq)平衡右移,使c(CrO42)增大,同时c(H+)也增大,共同促使Cr2O72+H2O
Ba2+(aq)+CrO42(aq)平衡右移,使c(CrO42)增大,同时c(H+)也增大,共同促使Cr2O72+H2O![]() 2CrO42+2H+平衡左移,可以生成更多的H2Cr2O7,故答案为:c(H2SO4)增大,则c(SO42-)增大,与Ba2+生成沉淀,促使BaCrO4(s)
2CrO42+2H+平衡左移,可以生成更多的H2Cr2O7,故答案为:c(H2SO4)增大,则c(SO42-)增大,与Ba2+生成沉淀,促使BaCrO4(s) ![]() Ba2+(aq)+CrO42(aq)平衡右移,c(CrO42)增大,同时c(H+)也增大,共同促使Cr2O72+H2O
Ba2+(aq)+CrO42(aq)平衡右移,c(CrO42)增大,同时c(H+)也增大,共同促使Cr2O72+H2O![]() 2CrO42+2H+平衡左移,可以生成更多的H2Cr2O7;
2CrO42+2H+平衡左移,可以生成更多的H2Cr2O7;
②. 根据表中各物质的溶度积常数可知,BaSO4与BaCrO4溶解度比较接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其难与H2SO4接触,阻碍重铬酸生成,故答案为:BaSO4与BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其难于接触H2SO4,阻碍重铬酸生成;
(4). 根据上述分析可知,沉淀BaCrO4并进一步回收重铬酸的效果与温度、浓度、溶液pH、硫酸浓度、沉淀颗粒等有关,受到溶液pH、温度、H2SO4浓度、BaCrO4颗粒大小等因素的影响,故答案为:受到溶液pH、温度、H2SO4浓度、BaCrO4颗粒大小等影响。
【题型】综合题
【结束】
19
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2mol·L-1Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2mol·L-1CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1mol·L-1Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经验检,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:__________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含![]() ,含有Cu+、Cu2+和
,含有Cu+、Cu2+和![]() 。
。
已知:Cu+![]() Cu+Cu2+,Cu2+
Cu+Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是__________。
②通过下列实验证实,沉淀中含有Cu2+和![]() 。
。

a.白色沉淀A是BaSO4,试剂1是__________。
b.证实沉淀中含有Cu2+和![]() 的理由是__________。
的理由是__________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无![]() ,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和__________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:
i.Al(OH)3所吸附;
ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
步骤一:

步骤二:__________(按上图形式呈现)。
b.假设ii成立的实验证据是__________。
(4)根据实验,亚硫酸盐的性质有__________。盐溶液间反应的多样性与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
I. ①H、D、T ②H2O、D2O ③石墨、金刚石 ④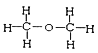 和
和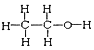
四组微粒或物质中,互为同位素的是_______;(填序号,下同)互为同素异形体的是_____。
II.现有①金刚石 ②干冰 ③Na2SO4 ④NH4Cl 四种物质,按下列要求回答:
(1)晶体熔化时需要破坏共价键的是_____(填序号,下同);
(2)熔点最低的是_______
(3)晶体中只存在一种微粒作用力是_______;
(4)属于离子晶体的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,燕令气.上……其清如水,味极浓烈,盖酒露也。“”这里所用的“法”是指
A. 萃取 B. 渗析 C. 蒸馏 D. 升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论错误的是( )
实验 | 实验现象 | 结论 |
A |
| 活动性:Al>Fe>Cu |
B |
| 铜与浓硝酸的反应产物是NO |
C |
| 增大反应物浓度,平衡向正反应方向移动 |
D |
| 装置气密性良好 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com