
【题目】CH4超干重整CO2技术可得到富含CO的气体,用于生产多种化工产品。该技术中的化学反应为:CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH=+330kJ/mol
2H2O(g)+4CO(g) ΔH=+330kJ/mol
(1)下图表示初始投料比n(CH4):n(CO2)为1:3或1:4,CH4的转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用a1、a2表示]

①a2=__________。
②判断T1的T2的大小关系,并说明理由:__________。
(2)CH4超干重整CO2的催化转化原理示意图如下:

①过程Ⅰ,生成1mol H2时吸收123.5kJ热量,其热化学方程式是__________。
②过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是__________。
③假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是__________。(填序号)
a.过程Ⅰ和过程Ⅱ中发生了氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料![]() ,可导致过程Ⅱ中催化剂失效
,可导致过程Ⅱ中催化剂失效
【答案】 1:4 T2>T1 正反应为吸热反应,温度升高时甲烷的转化率增大 CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol 4H2+Fe3O4![]() 3Fe+4H2O ac
3Fe+4H2O ac
【解析】(1). ①.在相同条件下,投料比越小,甲烷的转化率越大,据图可知,a2>a1,故a2表示的是1:4时甲烷的转化率,故答案为:1:4;
②. 因CH4(g)+3CO2(g)![]() 2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
(2). ①.在过程I中,生成1mol H2时吸收123.5kJ热量,据图可知,其热化学方程式为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol;
②. 由过程II的转化关系来看,混合气体中的H2将Fe3O4还原为Fe,反应方程式为:4H2+Fe3O4 ![]() 3Fe+4H2O,故答案为:4H2+Fe3O4
3Fe+4H2O,故答案为:4H2+Fe3O4 ![]() 3Fe+4H2O;
3Fe+4H2O;
③. a. 两个过程都有元素化合价的改变,都发生了氧化还原反应,故a正确;b. 过程II中Fe3O4最终被还原为Fe,Fe3O4不是催化剂,故b错误;c. 若初始投料比![]() 时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。
时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。
【题型】综合题
【结束】
17
【题目】工、农业废水以及生活污水中浓度较高的![]() 会造成氮污染。工业上处理水体中
会造成氮污染。工业上处理水体中![]() 的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
(1)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
①除锈反应的离子反程式是__________。
②判断铁屑洗净的方法是__________。
(2)将KNO3溶液的pH调至2.5。从氧化还原的角度分析调低溶液pH的原因是__________。
(3)将上述处理过的足量铁屑投入(2)的溶液中。如图表示该反应过程中,体系内相关离子浓度、pH随时间变化的关系。请根据图中信息回答:

①t1时刻前该反应的离子方程式是__________。
②t2时刻后,该反应仍在进行,溶液中![]() 的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
(4)铁屑与KNO3溶液反应过程中向溶液中加入炭粉,可以增大该反应的速率,提高![]() 的去除效果,其原因是__________。
的去除效果,其原因是__________。
【答案】 Fe2O3+6H+=2Fe3++3H2O 测最后一次洗涤液的pH,若为7,则说明铁屑已洗净(或取少量最后一次洗涤液加入BaCl2溶液,若无明显现象,则说明铁屑已洗净) ![]() 在酸性条件下的氧化性强,易被铁屑还原 4Fe+
在酸性条件下的氧化性强,易被铁屑还原 4Fe+![]() +10H+=4Fe2++
+10H+=4Fe2++![]() +3H2O 生成的Fe2+水解 炭粉和铁构成了无数微小的原电池加快反应速率
+3H2O 生成的Fe2+水解 炭粉和铁构成了无数微小的原电池加快反应速率
【解析】(1). ①. 铁锈的主要成分是Fe2O3,与稀硫酸反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
②. 判断铁屑是否洗净的方法是测最后一次洗涤液的pH,若为7,则说明铁屑已洗净,故答案为:测最后一次洗涤液的pH,若为7,则说明铁屑已洗净;
(2). pH调至2.5,是因为NO3-在酸性条件下的氧化性强,易被铁屑还原,故答案为:NO3-在酸性条件下的氧化性强,易被铁屑还原;
(3). ①. 根据图示可知,在t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则在t1时刻前是金属铁和硝酸之间的反应,即4Fe+NO3-+10H+=4Fe2++NH4++3H2O,故答案为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
②. 根据反应4Fe+NO3-+10H+=4Fe2++NH4++3H2O可知,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,所以原因是生成的Fe2+水解所致,故答案为:生成的Fe2+水解;
(4). 构成原电池可以加快化学反应速率,炭粉和铁屑构成了无数微小的原电池加快反应速率,故答案为:炭粉和铁构成了无数微小的原电池加快反应速率。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有下图所示的转化关系.已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体. 
请回答下列问题:
(1)写出A和C的名称或化学式:A , C;
(2)在上图D→C的过程中,D表现出强(填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是
的叙述错误的是
A. 原子序数116 B. 中子数177
C. 核外电子数116 D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是
A. 浓硫酸的质量增重 B. 澄清的石灰水变浑浊
C. 氢氧化钠的表面发生潮解 D. 钠的表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2molSO2和1molO2充入2L密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mo!,下列说法中正确的是
2SO3(g) △H=-197kJ/mo!,下列说法中正确的是
A. 反应达到平衡状态时,会放出197kJ的热量
B. 增大O2浓度可以使SO2转化率达到100%
C. 使用合适的催化剂、升高温度均可加大反应速率
D. 反应达到平衡时,正反应和逆反应的化学反应速率相等且不为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
A.920kJ
B.557kJ
C.436kJ
D.181kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体, D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。各物质之间的转换关系如下图,部分生成物省略。请回答下列问题:
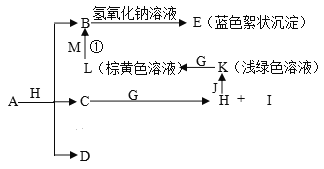
(1)写出A的化学式__________________,C的电子式______________________,
D的结构式______________________________。
(2)将22.4L(标准状况)D气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中除了Na+外,还大量存在的离子是______________________________。
(3)已知M溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式___________________________________________________________。
(4)检验化合物K中阳离子的实验方法是______________________________________
(5)写出反应K+G→L的化学方程式是________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com