
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是
的叙述错误的是
A. 原子序数116 B. 中子数177
C. 核外电子数116 D. 相对原子质量293
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置,电流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C可能是下列各组中的
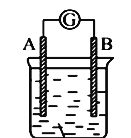
A. A是Ag,B是Fe,C为稀AgNO3溶液
B. A是Cu,B是Zn,C为稀H2SO4
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Zn,B是Cu,C为稀H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089 nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径 (nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | 2 | 3 | 1 | 3 |
(1)⑧号元素的在周期表中的位置是________________;上述元素处于同一主族的有_________________________。(用元素符号表示!)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为8电子的稳定结构,写出其电子式:__________________________(任写一种
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_____________________________________________________。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是________
用作高温堆减速剂。下列说法正确的是________
A. ![]() 和
和![]() 互为同位素 B.
互为同位素 B. ![]() 和
和![]() 属于同种核素
属于同种核素
C. ![]() 和
和![]() 的化学性质不同 D.
的化学性质不同 D. ![]() 和
和![]() 是同种物质
是同种物质
②下列说法不正确的是_________
A. 碱性:Be(OH)2 < LiOH < NaOH < KOH
B. 半径:K > Na > Li > Li+
C. 氧化性:Li+ < Na+ < K+ < Rb+ < Cs+
D. 金属性:Cs > Rb > K > Na > Li > Be
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向2L密闭容器中加入1mol NO和1mol活性炭,发生反应:
2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-213.5kJ/mol,达到平衡时的数据如下:
N2(g)+CO2(g) ΔH=-213.5kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | X | |
T2 | 0.25 |
下列说法不正确的是( )
A. T2℃时,若该反应经过10min达到平衡,反应速率v(NO)=0.025mol/(L·min)
B. T1℃时,若该反应的平衡常数K=9/16,则达平衡时NO的转化率为60%
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减少一半,平衡后NO的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若原子X的质子数为a,则X的质量数一定不为a
B.若两种元素形成的离子M2﹣和N+电子层结构相同,则离子半径M2﹣>N+
C.同周期非金属氧化物对应水化物酸性从左到右依次增强
D.由两种元素组成的化合物,若含有离子键,就没有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L1、0.2 mol·L1。向该混合液中加入1.92 g铜粉,加热,待充分反应后(假设反应前后溶液体积不变),所得溶液中的Cu2+的物质的量浓度(mol·L1)是( )
A. 0.15 B. 0.225 C. 0.3 D. 0.45
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的气体,用于生产多种化工产品。该技术中的化学反应为:CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH=+330kJ/mol
2H2O(g)+4CO(g) ΔH=+330kJ/mol
(1)下图表示初始投料比n(CH4):n(CO2)为1:3或1:4,CH4的转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用a1、a2表示]

①a2=__________。
②判断T1的T2的大小关系,并说明理由:__________。
(2)CH4超干重整CO2的催化转化原理示意图如下:

①过程Ⅰ,生成1mol H2时吸收123.5kJ热量,其热化学方程式是__________。
②过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是__________。
③假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是__________。(填序号)
a.过程Ⅰ和过程Ⅱ中发生了氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料![]() ,可导致过程Ⅱ中催化剂失效
,可导致过程Ⅱ中催化剂失效
【答案】 1:4 T2>T1 正反应为吸热反应,温度升高时甲烷的转化率增大 CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol 4H2+Fe3O4![]() 3Fe+4H2O ac
3Fe+4H2O ac
【解析】(1). ①.在相同条件下,投料比越小,甲烷的转化率越大,据图可知,a2>a1,故a2表示的是1:4时甲烷的转化率,故答案为:1:4;
②. 因CH4(g)+3CO2(g)![]() 2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
(2). ①.在过程I中,生成1mol H2时吸收123.5kJ热量,据图可知,其热化学方程式为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol;
②. 由过程II的转化关系来看,混合气体中的H2将Fe3O4还原为Fe,反应方程式为:4H2+Fe3O4 ![]() 3Fe+4H2O,故答案为:4H2+Fe3O4
3Fe+4H2O,故答案为:4H2+Fe3O4 ![]() 3Fe+4H2O;
3Fe+4H2O;
③. a. 两个过程都有元素化合价的改变,都发生了氧化还原反应,故a正确;b. 过程II中Fe3O4最终被还原为Fe,Fe3O4不是催化剂,故b错误;c. 若初始投料比![]() 时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。
时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。
【题型】综合题
【结束】
17
【题目】工、农业废水以及生活污水中浓度较高的![]() 会造成氮污染。工业上处理水体中
会造成氮污染。工业上处理水体中![]() 的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
(1)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
①除锈反应的离子反程式是__________。
②判断铁屑洗净的方法是__________。
(2)将KNO3溶液的pH调至2.5。从氧化还原的角度分析调低溶液pH的原因是__________。
(3)将上述处理过的足量铁屑投入(2)的溶液中。如图表示该反应过程中,体系内相关离子浓度、pH随时间变化的关系。请根据图中信息回答:

①t1时刻前该反应的离子方程式是__________。
②t2时刻后,该反应仍在进行,溶液中![]() 的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
(4)铁屑与KNO3溶液反应过程中向溶液中加入炭粉,可以增大该反应的速率,提高![]() 的去除效果,其原因是__________。
的去除效果,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元索形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_____________ (用元素符号表示,下同)。
(2)写出W的价电子排布式__________________________,W同周期的元素中,与W原子最外层电子数相等的元素还有_____________。
(3)X、Y、Z的简单氢化物的键角从大到小的顺序是__________________________(用化学式表示),原因是__________________________。
(4)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_____________,该物质硬度大,推测该物质为_____________晶体。其中Y元素的杂化方式是_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com