
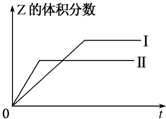
 (1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:
(1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:
| ||
| 2 |
| 0.2 |
| 1 |


科目:高中化学 来源: 题型:
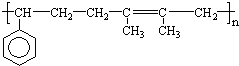
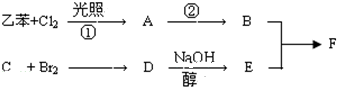
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
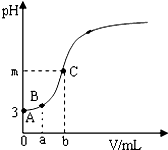 为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下:
为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下:| 编号 | V(CH3COOH)/mL | V(NaOH)/mL | |
| 初读数 | 末读数 | ||
| 1 | 25.00 | 0.00 | 25.00 |
| 2 | 25.00 | 1.00 | 26.02 |
| 3 | 25.00 | 1.10 | 26.08 |
| b |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠、钾着火时可用水灭火 |
| B、面粉厂或加油站不必严禁烟火 |
| C、氨气泄漏时可喷洒大量水进行处理 |
| D、皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的平衡浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A、2c1<c3 |
| B、a+b=92.4 |
| C、a1+a3<1 |
| D、p3>2p2=2p1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
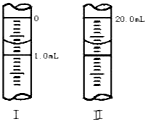 草酸与高锰酸钾在酸性条件下能够发生如下反应:
草酸与高锰酸钾在酸性条件下能够发生如下反应:| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有现象发生 |
| ② | B+D | 有气体放出 |
| ③ | B+C | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com