
| ||
| ||


科目:高中化学 来源: 题型:
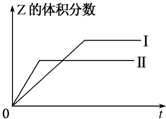 (1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:
(1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
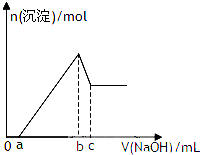 某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、NH4+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加人NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、NH4+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加人NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )| A、一定没有Cu2+、NO3-、Cl- |
| B、可能有K+、NH4+、NO3-、SO42- |
| C、不能确定是否含有K+、NO3- |
| D、一定有Mg2+、Al3+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上层橙红色,下层接近无色 |
| B、均匀、透明、紫红色 |
| C、均匀、透明、无色 |
| D、上层接近无色,下层紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入水时,平衡逆向移动 |
| B、加入少量NaOH固体,平衡正向移动 |
| C、加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 |
| D、加入少量CH3COONa固体,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A物质与B物质的反应速率之比为1:2 |
| B、单位时间内消耗a mol A,同时消耗3a mol C |
| C、容器内的压强不再变化 |
| D、混合气体的物质的量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑤ | B、①③⑥ |
| C、②⑤ | D、②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com