
| A、上层橙红色,下层接近无色 |
| B、均匀、透明、紫红色 |
| C、均匀、透明、无色 |
| D、上层接近无色,下层紫红色 |
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
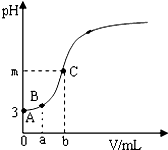 为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下:
为测定某品牌食用醋的总酸含量,取20.00mL该食用醋,用200mL容量瓶进行配制,然后分三次各取配制好的食用醋溶液25.00mL,用0.05000mol?L-1的NaOH溶液进行滴定,相关数据记录如下:| 编号 | V(CH3COOH)/mL | V(NaOH)/mL | |
| 初读数 | 末读数 | ||
| 1 | 25.00 | 0.00 | 25.00 |
| 2 | 25.00 | 1.00 | 26.02 |
| 3 | 25.00 | 1.10 | 26.08 |
| b |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有现象发生 |
| ② | B+D | 有气体放出 |
| ③ | B+C | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
| A、Fe3+、Cu2+、Cl-、NO3- |
| B、Fe2+、K+、SO42-、NO3- |
| C、Cu2+、Na+、CO32-、SO42- |
| D、Fe2+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由不同原子组成的纯净物一定是化合物 |
| B、碱性氧化物一定为金属氧化物 |
| C、化学式C6H5-CH3既能表示物质组成,又能表示物质分子式 |
| D、4,4-二甲基-2-己烯这种命名是错误的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol NH4+ 所含质子数为10NA |
| B、CO2的摩尔质量为44 g |
| C、常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
| D、标准状况下,22.4 LHCl溶于水形成1L溶液,所得溶液中溶质的物质的量浓度为22.4 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com