
【题目】I.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 。
(2)液氨是富氢物质,是氢能的理想载体,利用![]() 2NH3实现储氢和输氢。下列说法正确的是 。
2NH3实现储氢和输氢。下列说法正确的是 。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化 b.电负性顺序:C<N<O<F
c.由于氨分子间存在氢键,所以稳定性:NH3>PH3 d.[Cu(NH3)4]2+中N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是 。
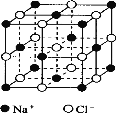
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示:
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则该Na+与跟它次近邻的Cl-的个数为 ,该Na+与跟它次近邻的Cl-之间的距离为 。
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为 (用含a、b的式子表示)。
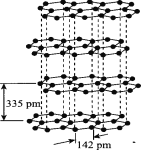
(3)硅与碳是同主族元素,其中石墨为混合型晶体,已知石墨的层间距为335 pm,C--C键长为142 pm,则石墨晶体密度约为 (列式并计算,结果保留三位有效数字,NA为6.02×1023 mol-)。
【答案】Ⅰ.(1)M 9
(2)bd
(3)N、F、H三种元素的电负性为F>N大于H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键。
Ⅱ.(1)8 ![]() r
r
(2)![]()
(3)2.27g/cm3
【解析】
试题分析:(1)基态Ti2+价电子排布式为:3d2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道;
(2)a.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,采用sp3杂化,a错误;b.非金属性越强,电负性越大,则电负性顺序:C<N<O<F ,b正确;c.氢化物的稳定性与共价键有关系,与氢键无关,氢键影响物理性质,c错误;d.提供孤电子对的原子是配原子,[Cu(NH3)4]2+离子中,N原子提供孤对电子,N原子为配原子,d正确;大小bd;
(3)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,由于N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键;
Ⅱ.(1)Na+位于顶点,被8个晶胞共有,即Na+与跟它次近邻的Cl-个数为8;Na+与跟它次近邻的Cl-之间的距离为晶胞体对角线的一半,距离为![]() r;
r;
(2)晶胞中共含有4个Na+和4个Cl-,体积为:![]() π(a3+b3)×4,晶胞的边长为a+b,晶胞体积为(2a+2b)3,氯化钠晶体中离子的空间利用率为
π(a3+b3)×4,晶胞的边长为a+b,晶胞体积为(2a+2b)3,氯化钠晶体中离子的空间利用率为![]() 。
。
(3)石墨的层间距为335pm,可以认为一层石墨的厚度是335pm。对某一层石墨中的一个六元环,正六边形环的边长是142pm,面积S=6×1/2×142×142sin(π/3)=52387.6pm2。环的厚度h=335pm那么一个环占有的体积V=Sh=52387.6×335=1.754×107pm3=1.754×10-23cm3。六元环中每个C原子都被3个环共用,一个环实际有2个C原子。一个环的质量m=2M/NA=2×12.01/(6.023×1023)=3.988×10-23g。
所以,石墨的密度ρ=m/V=3.988/1.754=2.27g/cm3。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
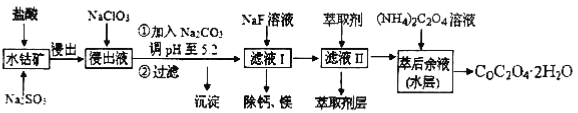
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_______________。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为
____________________________________________________________________________
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_______________________________________________________
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液=______。
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
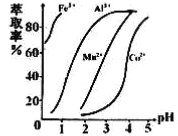
a.1 b.2 c.3 d.4
(6)已知:NH3·H2O![]() NH4++OH- Kb=1.8×10-5;
NH4++OH- Kb=1.8×10-5;
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2;HC2O4-
H++HC2O4- Ka1=5.4×10-2;HC2O4-![]() H++C2O42- Ka2=5.4×10-5;
H++C2O42- Ka2=5.4×10-5;
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
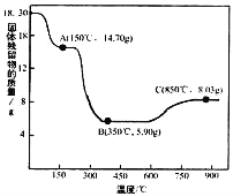
(7)CoC2O4·2H2O热分解质量变化过程如右图所示(其中600℃以前是隔绝空气加热,,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )

A.S2Cl2的电子式为![]()
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2 +2H2O===SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离。回答下列关于多元弱酸HnX的问题。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是__________。
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因:______________________________。
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液中c(H+)约为__________mol/L。(精确计算,且己知![]() )
)
(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各离子浓度由大到小的顺序是____________________。
②在KHC2O4溶液中,各粒子浓度关系正确的是__________。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O42-)+2c(C2O42-)
D.c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是( )。
A. 可用25mL碱式滴定管量取20.00mL KMnO4溶液
B. 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C. 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
D. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X、Y、Z三元素的基态原子2p能级都有单电子,单电子个数分别是2,3,2;G与T原子序数相差18,T元素是周期表中ds区的第一种元素;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料。
(1)Y原子核外共有________种不同运动状态的电子,T元素基态原子有________种不同能级的电子。________种形状不同的原子轨道。
(2)X、Y、Z的电负性由大到小的顺序为________,G、Q、R第一电离能由小到大的顺序为________(用元素符号表示)。
(3)Y元素基态原子的电子排布图________,T元素基态原子的价电子排布式________。
(4)XZ2的电子式为________,用电离方程式表示Y的最简单氢化物的水溶液呈碱性的原因________。
(5)+1价气态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5···,推测G元素的电离能突增应出现在第________电离能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O的装置和部分操作步骤如图所示。
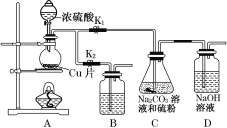
Ⅰ.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时即停止C中的反应。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①步骤Ⅰ中,圆底烧瓶内发生反应的化学方程式是_________________。
②步骤Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是____________。“停止C中的反应”的操作是____________________________________。
③装置B中盛放的试剂是________溶液(填化学式),其作用是___________________。
(2)依据反应2S2O+I2=S4O+2I-,可用I2的标准溶液测定产品的纯度。取5.5 g产品,配制成100 mL溶液。取10 mL溶液,以淀粉溶液为指示剂,用浓度为0.050 mol·L-1的标准溶液进行滴定,相关数据记录如表所示。
编号 | 1 | 2 | 3 | 4 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
①判断达到滴定终点的现象是__________________________________________。
②Na2S2O3·5H2O(式量M=248)在产品中的质量分数是(计算结果保留1位小数)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮锌镀层厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放人6 mol.L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片,用水冲洗、烘干后称量,得质量为m2 。下列说法正确的是
A.设锌镀层厚度为h,锌的密度为ρ,则![]()
B.锌电极的电极反应式为2H2O+2e-==H2↑+2OH-
C.锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨
D.当石墨上不再有气泡时,立即取出铁片,冲洗后用酒精灯加热烘干,铁片可能部分被氧化,导致实验结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为甲同学设计的制取并检验C2H4性质的实验装置图。请回答有关问题:
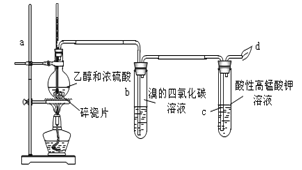
(1)写出上述制乙烯的反应的化学方程式: ,
(2)加入几片碎瓷片的目的是 ,
(3)加热时,使混合液温度迅速升高到170℃,是为了 ,
(4)实验过程观察到的现象为:
①Br2的四氯化碳溶液由 色变 ,
②酸性KMnO4溶液 。
(5)乙同学认为甲同学设计的实验如果仅从酸性KMnO4溶液褪色难以证明反应有乙烯生成,因为反应产生的乙烯中可能混有 气体也能使酸性KMnO4溶液褪色。写出此气体使酸性KMnO4溶液褪色的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com