
【题目】科学家采用碳基电极材料设计了一种制取氯气的新工艺方案,装置如图所示:下列说法错误的是( )

A.反应过程中需要不断补充Fe2+
B.阳极反应式是2HCl- 2e- =Cl2+2H+
C.电路中转移1 mol电子,消耗标况下氧气5.6 L
D.电解总反应可看作是4HCl(g)+O2(g)=2Cl2(g) + 2H2O(g)
【答案】A
【解析】
HCl在阳极失电子,发生氧化反应,生成Cl2和H+,Fe3+在阴极得电子,还原成Fe2+,Fe2+、H+、O2反应生成Fe3+和H2O,Fe2+、Fe3+在阴极循环。
A.由分析可知,Fe2+在阴极循环,无需补充,A错误;
B.HCl在阳极失电子得到Cl2和H+,电极反应式为:2HCl- 2e- =Cl2+2H+,B正确;
C.根据电子得失守恒有:O2~4e-,电路中转移1 mol电子,消耗0.25mol氧气,标况下体积为5.6 L,C正确;
D.由图可知,反应物为HCl(g)和O2(g),生成物为H2O(g)和Cl2(g),故电解总反应可看作是4HCl(g)+O2(g)=2Cl2(g)+ 2H2O(g),D正确。
答案选A。


科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。
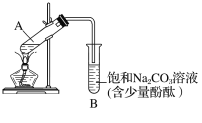
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄
B.下层液体红色变浅或变为无色
C.有气体产生
D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
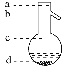
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外,还需要的玻璃仪器有__________、________、________、________,收集乙酸的适宜温度是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )

下列说法正确的是( )
A.反应过程中NO2、NH4+之间的反应是氧化还原反应
B.上述历程的总反应可以为:2NH3+NO+NO2 2N2+3H2O
2N2+3H2O
C.X是HNO2,是还原产物
D.[(NH4)(HNO2)]+是反应过程中的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1NaOH溶液分别滴定20.00ml 0.100mol·L-1的盐酸和醋酸,滴定曲线如下图所示。下列说法正确的是( )

A. Ⅱ表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于滴定盐酸消耗的V(NaOH)
C. V(NaOH)=10.00mL时,醋酸溶液中C(CH3COO-)+2C(H+)=C(CH3COOH)+2C(OH-)
D. V(NaOH)=20.00mL时,两份溶液中C(Cl-)=C(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢气是一种未来十分理想的能源。
镧镍合金是一种良好的储氢材料,在一定条件下通过如下反应实现储氢:
LaNi3(s)+3H2(g) ![]() LaNi3H6(s) H<0。 某实验室模拟该过程,向体积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如下左图所示;一定温度(T)下,将a mol的氢气充入体积是1 L的容器内,气体的压强(P)随时间(t)的变化关系如下右图所示:
LaNi3H6(s) H<0。 某实验室模拟该过程,向体积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如下左图所示;一定温度(T)下,将a mol的氢气充入体积是1 L的容器内,气体的压强(P)随时间(t)的变化关系如下右图所示:

①n1、n2、n3的大小关系是_______。
②温度T1下反应的平衡常数是__________(用含a的代数式表示)。
③保持温度不变,在t6时刻将容积压缩至原容积的一半,容器内的压强_________6kPa(填写“大于”或“小于”)。
(2)贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应①![]()
②![]()
③![]()
![]() _______。
_______。
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应②(已排除其他反应干扰),测得CO(g)物质的量分数随时间变化如下表所示:

若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0-5分钟内的速率v[H2O(g)]=______。6分钟时,仅改变一种条件破坏了平衡,且第9min达到平衡时,CO的物质的量是0.2mol,则改变的外界条件为_________。
(4)温度、压强对反应CO(g)十2H2(g)=CH3OH(g) H=-90. 1 kJ·mol-1中CO转化率的影响如图所示:

①温度在较低范围内,对CO转化率影响的主要因素是____________ (填“温度”或“压强”)。
②由图像可知,温度越低,压强越大,CO转化率越高。但实际生产往往采用300~400 °C和10 MPa的条件,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝或银丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。
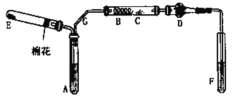
(1)为使A中乙醇平稳地汽化成乙醇蒸气,常采用的方法是_____________。
(2)若E中的固体为纯净物,则E的化学式是_____________。
(3)写出B处发生反应的化学方程式_____________
(4)加热F处的混合液的实验现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为_____。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3并推断Na2CO3的水解程度______NaHCO3 (填”大于”或”小于”)。丙同学认为甲、乙的判断都不充分。
丙认为: (1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填”甲”或”乙”)判断正确。试剂X是____。
A.Ba(OH)2溶液 B.BaCl2溶液 C.AlCl3溶液 D.澄清石灰水
(2)查阅资料发现NaHCO3的分解温度为150℃,丙断言____(填”甲”或”乙”)的判断是错误的,理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lgc(M2+),p(CO32-)=-lgc(CO32-),XCO3溶解度比YCO3大。下列说法正确的是
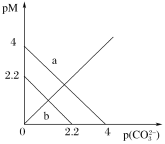
A.线b表示YCO3的溶解平衡曲线
B.a、b线上任意点均存在c(M2+)=c(CO32-)
C.t ℃时,XCO3(s)+Y2+(aq)![]() YCO3(s)+X2+(aq)平衡常数为K,其数量级为102
YCO3(s)+X2+(aq)平衡常数为K,其数量级为102
D.向YCO3悬浊液中加入饱和X(NO3)2溶液,可能有XCO3生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com