
【题目】25℃时,向20 mL 0.01 mol·L-1HA(aq)中不断滴入0.02 mol·L-1 NaOH(aq),混合溶液pH变化如图所示。此过程溶液下列说法不正确的是(已知:25℃时一元酸HA(aq)电离平衡常数Ka=1.6×10-5)

A. a点溶液的pH大于3
B. b点溶液中离子:c(A-)>c(Na+)>c(H+)>c(OH-)
C. c点表示酸HA(aq)和NaOH(aq)溶液恰好完全反应
D. d点溶液加水稀释后c(H+)/c(HA)的值会增大
【答案】C
【解析】
A、a点时,为0.01 mol·L-1HA溶液,根据电离常数计算c(H+);
B、b点溶液为HA和NaA的混合物,溶液呈酸性;
C、根据反应方程式,结合溶液呈中性进行判断;
D、d点溶液存在A-的水解平衡,在一定温度下水解平衡常数不变,据此分析。
A、a点时,为0.01 mol·L-1HA溶液,已知25℃时一元酸HA(aq)电离平衡常数Ka=1.6×10-5,
HA![]() H++A-
H++A-
起始浓度(mol/L) 0.01 0 0
平衡浓度(mol/L) 0.01-x x x
![]() =1.6
=1.6![]() 10-5,由于x很小,0.01-x
10-5,由于x很小,0.01-x![]() 0.01,则x2=1.6
0.01,则x2=1.6![]() 10-7,解得x=4
10-7,解得x=4![]() 10-4,pH=-lg4
10-4,pH=-lg4![]() 10-4=4-2lg2=4-2
10-4=4-2lg2=4-2![]() 0.3=3.4>3,故A正确;
0.3=3.4>3,故A正确;
B、b点时酸过量,溶液为HA和NaA的混合物,溶液呈酸性,应存在c(A-)>c(Na+)>c(H+)>c(OH-),故B正确;
C、若酸HA(aq)和NaOH(aq)溶液恰好完全反应则生成NaA为强碱弱酸盐,水解显碱性,pH>7,与c点溶液呈中性不符,故C错误;
D、d点为NaOH和NaA的混合物,溶液中存在醋酸根离子的水解平衡:A -+H2O![]() HA+OH-,水解常数Kh=
HA+OH-,水解常数Kh=![]() =
=![]() ,在一定温度下不变,加水稀释后,c(A-)减小,则c(HA) /c(H+)减小,故c(H+)/c(HA)的值增大,故D正确;
,在一定温度下不变,加水稀释后,c(A-)减小,则c(HA) /c(H+)减小,故c(H+)/c(HA)的值增大,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:

回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,需用到的玻璃仪器有_____;过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是______。
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g2=0.3,溶液体积变化忽略不计)。
(8)写出“高温烧结固相合成”过程的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L密闭容器中进行如下反应:X(g)+3Y(g)![]() 2Z(g),达到平衡时 X、Y、Z的物质的量分别为 0.1mol、0.3mol、0.2mol,保持温度和容器体积不变时,再向容器中充入X、Y、Z的物质的量0.1mol、0.3mol、0.2mol,则下列说法正确的是
2Z(g),达到平衡时 X、Y、Z的物质的量分别为 0.1mol、0.3mol、0.2mol,保持温度和容器体积不变时,再向容器中充入X、Y、Z的物质的量0.1mol、0.3mol、0.2mol,则下列说法正确的是
A. 化学平衡常数不变,平衡不移动 B. 向正反应方向移动
C. 向逆反应方向移动 D. 容器内压强始终保持原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气法制取甲醇(CH3OH)的反应及其反应的焓变、平衡常数如下:
① CH4(g) + 1/2 O2(g)![]() CO(g) + 2H2(g)
CO(g) + 2H2(g) ![]() H1 =-35.4kJ·mol-1 平衡常数K1
H1 =-35.4kJ·mol-1 平衡常数K1
② CO(g) + 2H2(g) ![]() CH3OH (g)
CH3OH (g) ![]() H2 =-90.1 kJ·mol-1 平衡常数K2
H2 =-90.1 kJ·mol-1 平衡常数K2
③ 2CH4(g) + O2(g) ![]() 2CH3OH(g)
2CH3OH(g) ![]() H3 平衡常数K3
H3 平衡常数K3
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________。
(2)依据盖斯定律求出反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g)
2CH3OH(g) ![]() H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
(3)下列关于化学反应中的能量及变化理解错误的是(填字母序号)______。
a.反应中活化能的作用是使反应物活化,从而启动反应或改变反应速率
b.化学键的断裂与形成一定伴随着电子的转移和能量变化
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(![]() H)决定
H)决定
d.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
e.200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应,热化学方程式表示如下:
H2(g)+I2(g) === 2HI(g) ![]() H3 = -14.9 kJ·mol-1
H3 = -14.9 kJ·mol-1
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了
(4)甲醇燃料电池的种类很多,我们常用的一种甲醇燃料电池,是以甲醇与氧气的反应为原理设计的,其电解质溶液是KOH溶液。该电池负极的电极反应式为_____________________________。
如图是自呼吸式甲醇燃料电池工作示意图。图中进入c口的物质可能是______________,若有16g甲醇参与原电池反应,理论上电池内部有___________mol 质子通过质子交换膜。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3 mol A和2 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) ![]() 2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
(1)该过程用A表示的反应速率为:v(A)=_______;该温度下该反应的化学平衡常数表达式为__________。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)______α(B)(填“>”、“=”或“<”)。
(3)判断反应达到平衡状态的依据是(填字母序号)__________。
a.生成C的速率与消耗B的速率相等 b.混合气体的密度不变
c.混合气体的相对平均分子质量不变 d.A的质量分数不再发生变化
(4)若升高温度,再次达平衡时,平衡常数数值变大,则该反应的![]() H_____0(填“>”、“=”或“<”)。
H_____0(填“>”、“=”或“<”)。
(5)若保持温度不变时,继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,则化学反应速率会__________(填“加快”、“减慢”或“不变”),化学平衡将_________(填“正反应方向移动”、“逆反应方向移动”或“不移动”)。
(6)在恒温恒容密闭容器中进行上述反应,起始投料时各物质的浓度如下表:
A | B | C | |
投料I | 3.0 mol/L | 1.0 mol/L | 0 |
投料II | 2.0 mol/L | 1.0 mol/L | 2.0 mol/L |
按投料I进行反应,测得达到化学平衡状态时A的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”、“逆向”或“不移动)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可以通过电解法进行制备,装置如图所示,下列说法错误的是
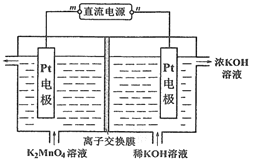
A. 阳极的电极反应式:MnO42- – e-= MnO4-
B. 该装置的离子交换膜为阳离子交换膜
C. 当电路通过a mol电子时,阴极室电解质溶液增加2a mol离子
D. 若电解流出液中KMnO4、K2MnO4和KOH物质的量之比为a∶b∶c,则流进电解池的电解液中K2MnO4和KOH的物质的量之比为 (a + b)∶( c + a )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com