
【题目】氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步具有极其重要的意义.
(1)已知:2BrO3﹣+C12═Br2+2C1O3﹣; 5C12+I2+6H2O═2HIO3+10HC1;C1O3﹣+5C1﹣+6H+═3C12+3H2O则C1O3﹣、BrO3﹣、IO3﹣、C12的氧化性由弱到强的排序为
(2)已知Fe3+的氧化性强于I2 , 请你从所给试剂中选择所需试剂,设计一个实验加以证明.(提示:请写出实验步骤、现象及结论)①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
(3)二十世纪初期,化学家合成出极易溶于水的NaBH4 . 在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以BO2﹣形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
(4)某强氧化剂[RO(OH)2]+能将Na2SO3氧化.已知含2.0×10﹣3mol[RO(OH)2]+离子的溶液,恰好跟25.0mL 0.2mol/L 的Na2SO3溶液完全反应,则反应后R的化合价为价.
(5)将32g 铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
①待产生的气体全部释放后,向溶液加入V mL amolL﹣1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为mol/L.(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3 , 至少需要H202的质量为g.
【答案】
(1)IO3﹣<C12<C1O3﹣<BrO3﹣
(2)取少量FeCl3溶液于试管中,依次加入KI溶液和淀粉溶液,振荡,若溶液变蓝,证明Fe3+的氧化性强于I2
(3)8Au3++3BH4﹣+24OH﹣=8Au+3BO2﹣+18H2O
(4)0
(5)![]() ;17
;17
【解析】解:(1.)由反应①可知,氧化性BrO3﹣>C1O3﹣ , 由反应②可知,氧化性C12>IO3﹣ , 由反应③可知,氧化性C1O3﹣>C12 , 故氧化性IO3﹣<C12<C1O3﹣<BrO3﹣;所以答案是:IO3﹣<C12<C1O3﹣<BrO3﹣;
(2.)选取含有Fe3+和I﹣的试剂,若能生成I2 , 则能使淀粉溶液变蓝,所以选取①FeCl3溶液③KI溶液⑤淀粉溶液,取少量FeCl3溶液于洁净试管中,依次加入KI溶液和淀粉溶液,振荡,若溶液变蓝,证明Fe3+的氧化性强于I2 .
所以答案是:取少量FeCl3溶液于试管中,依次加入KI溶液和淀粉溶液,振荡,若溶液变蓝,证明Fe3+的氧化性强于I2;
(3.)NaBH4与Au3+发生氧化还原反应生成NaBO2和Au,反应前后B的化合价不变,H元素化合价由﹣1价变为0价,Au3+由+3价变为0价,结合转移电子守恒则离子方程式为:8Au3++3BH4﹣+24OH﹣=8Au+3BO2﹣+18H2O;所以答案是:8Au3++3BH4﹣+24OH﹣=8Au+3BO2﹣+18H2O;
(4.)n(Na2SO3)=25×10﹣3L×0.2mol/L=5×10﹣3mol,被氧化后生成Na2SO4 , [RO(OH)2]+离子中R的化合价为+5价,设还原后的化合价为a,
根据电子转移守恒:5×10﹣3mol×(6﹣4)=2×10﹣3mol×(5﹣a),解得a=0,所以答案是:0;
(5.)①将铜离子完全转化为硝酸钠时,根据钠原子守恒得n(NaOH)=n(NaNO3)=0.001aVmol,根据硝酸根离子守恒得起酸作用的硝酸的物质的量=0.001aVmol,根据N原子守恒作氧化剂的硝酸的物质的量=0.5mol,所以硝酸的物质的量浓度= ![]() =
= ![]() mol/L,所以答案是:
mol/L,所以答案是: ![]() ;②设需要双氧水mg,根据电子得失守恒,有:
;②设需要双氧水mg,根据电子得失守恒,有: ![]() ×2=
×2= ![]() ×2,解得:m=17,所以答案是:17.
×2,解得:m=17,所以答案是:17.
【考点精析】本题主要考查了氧化性、还原性强弱的比较的相关知识点,需要掌握金属阳离子的氧化性随其单质还原性的增强而减弱;非金属阴离子的还原性随其单质的氧化性增强而减弱;不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强;当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强才能正确解答此题.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)新型净水剂替代传统的净水剂Cl2 , 对淡水进行消毒是城市饮用水处理的新技术.
(1)已知ClO2在水处理过程中被还原为Cl﹣ . 若以单位质量的氧化剂所得到的电子数来表示消毒效率,则ClO2、Cl2两种消毒剂的消毒效率较大的是哪种 . (填化学式)
(2)ClO2的制备方法:
①工业上可用Cl2氧化NaClO2溶液制取ClO2 . 写出该反应的离子方程式,并标出电子转移的方向和数目 .
②实验室通常以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下: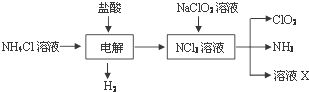
推测溶液X为 .
(3)ClO2是一种黄绿色有刺激性气味的气体,实验室通常用NaOH溶液来吸收ClO2 , 以减少环境污染.
若实验时需要450mL 4mol/L的NaOH溶液,则配制时,需要用托盘天平称取NaOH的质量为g,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还必须有 . 配制该溶液时,下列操作会使溶液浓度偏高的是 . (填字母)
A.称量固体时动作缓慢
B.容量瓶未干燥立即用来配制溶液
C.NaOH固体溶解后立刻转移
D.在容量瓶定容时俯视刻度线
E.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种气体的分子数一定相等的是
A. 质量相等、密度不等的N2和C2H4 B. 等压等体积的N2和CO2
C. 等体积等密度的CO2和C2H4 D. 等温等体积的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实所对应的方程式不正确的是( )
A.盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2NaOH═Na2SiO3+H2O
B.高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g) ![]() 2Fe(OH)3+3H2
2Fe(OH)3+3H2
C.工业制取漂粉精:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
D.实验室制取氨气:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g).若经2s 后测得C的浓度为 0.6molL﹣1 , 现有下列几种说法:①用物质A表示的反应的平均速率为 0.6mol(Ls)﹣1;②用物质B表示的反应的平均速率为 0.15mol(Ls)﹣1;③2s 时物质A的浓度为1.4molL﹣1;④2s 时物质B的转化率为70%.其中正确的是( )
A.①③
B.①④
C.②③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,发生3A(g)+B(g)2C(g)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12molL﹣1s﹣1 , 则10s后容器中B的物质的量是( )
A.1.6 mol
B.2.8 mol
C.3.2 mol
D.3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aX(g)+bY(g)cZ(g)+dW(g)在一定体积的密闭容器中反应5min达到平衡时,X减少n molL﹣1 , Y减少 ![]() molL﹣1 , Z增加
molL﹣1 , Z增加 ![]() molL﹣1 . 若将体系压强增大,W的百分含量不发生变化.则化学方程式中各物质的化学计量数之比a:b:c:d应为( )
molL﹣1 . 若将体系压强增大,W的百分含量不发生变化.则化学方程式中各物质的化学计量数之比a:b:c:d应为( )
A.3:1:2:1
B.1:3:2:2
C.3:1:2:2
D.1:3:1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com