
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 10 |
| 1 |
| 10 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 10 |
| 1 |
| 2 |
| 1 |
| 2 |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
(
| ||||||||
| (1-x) |
| 1 |
| 10 |
| 0.17mol |
| 1.0mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通常情况下,87g丙酮分子中含有的π键键数为1.5NA |
| B、标准状况下,11.2 L三氯甲烷分子中含有的σ键键数为2NA |
| C、2.5 mol乙醛与足量的氢气完全加成,断裂的π键键数为2.5NA |
| D、15 g 氨基乙酸通过成肽反应全部生成二肽时,生成的肽键键数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
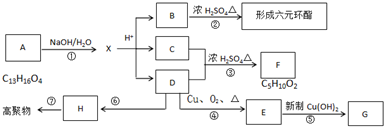
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加稀HCl将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀 |
| B、先加稀HNO3将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀 |
| C、向溶液中滴加稀盐酸酸化的BaCl2溶液,看是否生成白色沉淀 |
| D、向溶液中滴加稀硝酸酸化的BaCl2溶液,看是否生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C、酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D、读取盐酸体积时,开始仰视读数,滴定结束时平视读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com