
溴碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。提取碘的途径如下所示:

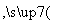

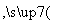


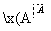
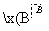


下列有关叙述正确的是( )
A.碘元素在海水中只有化合态存在
B.在提取的过程中用的氧化剂可以是H2O2
C.操作A是结晶或重结晶
D.B是提纯操作,常用蒸馏或分馏
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知:

(1)A 为一元羧酸,8.8 g A 与足量 NaHCO3 溶液反应生成 2.24 L CO2(标准状况),A 的分子式为______________________________。
(2)写出符合 A 分子式的所有甲酸酯的结构简式:____________________________。
(3)B 是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:________________________________________________________。
(4)C+E→F的反应类型为________。
(5)写出 A 和 F 的结构简式:
A____________;F____________。
(6)D 的苯环上有两种氢,它所含官能团的名称为________;写出a、b所代表的试剂:a__________________;
b__________________。
Ⅱ.按如下路线,由 C 可合成高聚物 H:
C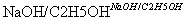 G
G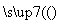 H
H
(7)C→G 的反应类型为________。
(8)写出G→H 的反应方程式:____________________________________
_____________________________ ___________________________________________。
___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应4A(s)+3B(g)  2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示正确的是
2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示正确的是
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示的反应速率其比值是3∶2∶1
C.2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中提取单质镁,下列途径正确的是( )
A.海水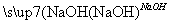 Mg(OH)2
Mg(OH)2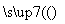 Mg
Mg
B.海水 MgCl
MgCl 2
2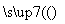 Mg
Mg
C.海水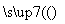 Mg(OH)2
Mg(OH)2 MgCl2
MgCl2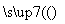 Mg
Mg
D.海水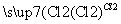 MgCl2
MgCl2 Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应广泛应用于金属冶炼,下列说法不正确的是( )
A.电解熔融氯化钠制取金属钠的反应中,钠离子被还原
B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C.用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol 电子
D.铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
我们知道海带中含有碘元素,经常食用海带可以防治甲状腺肿大,所以工业上常用海带为原料提取碘单质。查有关资料可知碘单质有升华现象。下面是某校化学探究小组设计的从海带中提取单质碘的实验,请你完成下列实验。
(1)将干燥洁净的海带用酒精湿润后在__________(填一种仪器名称)中灼烧成灰烬。
(2)将海带灰烬冷却至室温,转移到烧杯中,加蒸馏水后,搅拌、煮沸、冷却、__________(填一种操作名称)。
(3)在滤液中滴入几滴稀硫酸,再加入一定量的过氧化氢溶液,此时发生反应的离子方程式为:__________________________________。
(4)把(3)中所得到的溶液注入分液漏斗中,然后再加入四氯化碳,振荡、静置,可以观察到四氯化碳层呈________色。经分液得到碘的四氯化碳溶液,在这一实验过程中,四氯化碳起____________作用。
(5)用试管取碘的四氯化碳溶液用水浴加热,待四氯化碳挥发完即可得到固体碘单质。为什么不用酒精灯直接加热蒸发四氯化碳:_____________________________。
(6)证明得到的固体是碘单质的化学方法是_____________________________________
__________________________________ ______________________________________。
______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,灼烧上述残留物,最后得到的物质是
A.NaCl、I2 B.NaCl、NaBr C.NaBr、I2 D.NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
工业上有一种方法是用CO2来生产燃料甲醇,298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如图1所示,据图回答问题:


图1 图2
(1)写出合成甲醇反应的热化学方程式 ;
(2)在图中曲线 (填“a”或“b”)表示加入催化剂的能量变化曲线。
(3)在体积为l L的密闭容器中,充入lmolCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数为__________________,升高温度,K值 (填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为:_______________________________ 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com