
【题目】阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①标准状况下,2.24L水中含有0.1 NA个水分子
②常温常压下,32gSO2 含有的分子数约为3.01×1023
③2 molNaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤室温下,32gO2和O3的混合气体中含有的氧原子数为2NA
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2L氯气中含有 NA个氯原子
⑨在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑩标准状况下14gCO含有的核外电子数为10NA
A.①③④⑥⑧⑩B.①④⑤⑥⑧⑨
C.①②④⑥⑧⑨D.②③④⑤⑦⑩
【答案】A
【解析】
①标准状况下,水不是气体,不能使用标况下的气体摩尔体积计算2.24L水的物质的量,故①错误;
②常温常压下,32g SO2的物质的量为0.5mol,含有的分子数约为3.01×1023,故②正确;
③2mol NaOH的摩尔质量为40g/mol,摩尔质量与物质的量无关,故③错误;
④没有告诉在标况下,H2的气体摩尔体积不一定为22.4L/mol,故④错误;
⑤32gO2和O3的混合气体中氧原子的物质的量为:![]() =2mol,则氧原子数为2NA,故⑤正确;
=2mol,则氧原子数为2NA,故⑤正确;
⑥没有告诉2mol/L的CaCl2溶液的体积,无法计算溶液中氯离子的物质的量,故⑥错误;
⑦常温常压下,1mol氦气含有1mol氦原子,含有的原子数为NA,故⑦正确;
⑧没有告诉在标况下,题中条件无法计算11.2L氯气的物质的量,故⑧错误;
⑨在标准状况下,22.4L由N2和N2O组成的混合气体的物质的量为1mol,1mol混合气体中含有2mol氮原子,所含有的氮原子的物质的量为2mol,故⑨正确;
⑩14g CO的物质的量为0.5mol,0.5mol一氧化碳中含有7mol电子,含有的核外电子数为7NA,故⑩错误;
综上,错误的有①③④⑥⑧⑩。
答案选A。


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质能用括号内的试剂等鉴别的是 ()
A.![]() 和
和![]() 两种溶液(焰色反应)
两种溶液(焰色反应)
B.NaCl和![]() 两种溶液(激光笔)
两种溶液(激光笔)
C.![]() 溶液
溶液![]() 两种溶液(NaOH溶液)
两种溶液(NaOH溶液)
D.![]() 和
和![]() 两种溶液(KSCN溶液)
两种溶液(KSCN溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工原料,以下是以乙烯为原料制备的常见有机物的示意图:
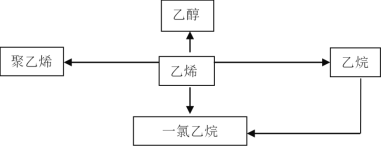
(1)乙烯的电子式为________________,其同系物的通式为_____________。
(2)工业上用乙烯制备乙醇的化学方程式为____________________________。
(3)聚乙烯薄膜常用作食品包装材料,写出由乙烯制聚乙烯的化学方程式:_______,此反应类型为_______反应。
(4)制备一氯乙烷常有两种方法:①用乙烷与氯气在光照条件下反应制取;②用乙烯在加热使用催化剂的条件下与氯化氢气体反应制取。比较两种制备方法,你认为比较好是哪一种?___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是(假设金属的摩尔质量为Mg·mol-1金属原子半径为r cm,用NA表示阿伏加德罗常数的值)

A.金属Zn采用②堆积方式
B.①和③中原子的配位数分别为:6、8
C.对于采用②堆积方式的金属的晶胞质量为![]()
D.金属锻压时,会破坏密堆积的排列方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
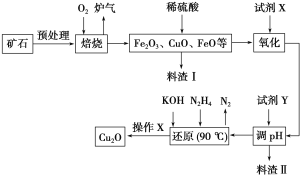
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子结构与性质的说法正确的是( )
A.![]() 的基态原子的第一电离能依次递增
的基态原子的第一电离能依次递增
B.![]() 的基态电子排布式为
的基态电子排布式为![]()
C.![]() 有6种不同能量的电子
有6种不同能量的电子
D.化合物![]() 中S元素显-2价,说明C元素比S元素的电负性弱
中S元素显-2价,说明C元素比S元素的电负性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集和转化是科学研究中的热点问题。我国科研人员提出了以Ni/Al2O3为催化剂,由 CO2(g)和H2(g)转化为CH4(g)和H2O(g)的反应历程,其示意图如下:
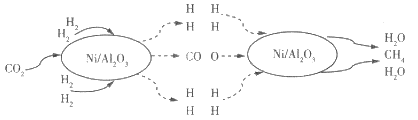
(1)该可逆反应的化学方程式为_________。使用催化剂Ni/Al2O3_________ (填“能”或“不能”)提髙CO2的平衡转化率。
(2)300℃下,在一恒容密闭容器中充入一定量的CO2与H2,发生上述反应,一段时间后反应达平衡,若其他条件不变,温度从300℃升至500℃,反应重新达到平衡时,H2的体积分数增加。下列说法错误的是_________(填标号)。
A.该反应的![]()
B.平衡常数大小:![]()
C.300℃下,减小![]() 的值,
的值,![]() 的平衡转化率升高
的平衡转化率升高
D.反应达到平衡时化![]()
(3)在一定条件下,反应体系中CO2的平衡转化率a( CO2)与L和X的关系如图所示,L和X表示温度或压强。
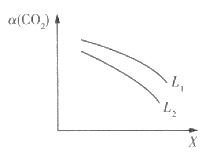
①X表示的物理量是___________。
②L1_____________L2(填“<”“>”),判断理由是______________________________________。
(4)向1 L恒容密闭容器中加入4.0 mol H2(g),1.0 mol CO2,控制条件(催化剂为 Ni/AI2O3、温度为T1)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示。
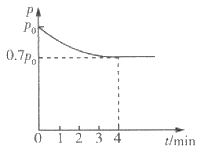
①4 min时CO2的转化率为___________。
②T1温度下该反应的化学平衡常数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com