
 亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl
亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl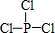 .
.分析 (1)PCl3中P原子与Cl原子之间形成1对共用电子对;
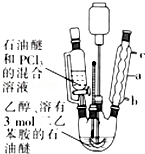
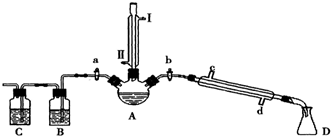
(2)由仪器结构特征,可知仪器a为球形冷凝管;采取逆流原理,通入冷凝水进行冷却;
(3)酯化反应为可逆反应,反应生成HCl,而二乙苯胺呈碱性,根据平衡移动原理分析解答;
(4)反应为可逆反应,加入NaOH溶液,调节pH至7,水洗、过滤后,蒸馏收集得产品,氢氧化钠作用是除去氯化氢和未反应的三氯化磷;
(5)用水洗除去溶于水的杂质;
(6)1.1mol三氯化磷完全反应需要3.3mol乙醇,而实际加入3mol乙醇,故乙醇不足,根据乙醇计算亚磷酸三乙酯的理论产量,产率=(实际产量÷理论产量)×100%.
解答 解:(1)PCl3中P原子与Cl原子之间形成1对共用电子对,其结构式为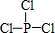 ,故答案为:
,故答案为: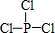 ;
;
(2)由仪器结构特征,可知仪器a为球形冷凝管;采取逆流原理,使冷凝管中充满冷凝水,充分冷却,回流时水应从b口进c口出;
故答案为:球形冷凝管;b;
(3)PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl属于酯化反应,反应是可逆反应,反应生成HCl,而二乙苯胺呈碱性,可以消耗生成的HCl,促进反应向正反应移动,提高原料的转化率,
故答案为:消耗反应生成的HCl,使反应向正反应方向移动,从而提高原料的转化率;
(4)反应为可逆反应,加入NaOH溶液,调节pH至7,水洗、过滤后,蒸馏收集得产品,氢氧化钠作用是除去未反应的PCl3及溶解在其中的HCl,
故答案为:除去未反应的PCl3及溶解在其中的HCl;
(5)产品中会溶解溶于水的杂质,用水洗可以除去易溶于水的杂质,故答案为:除去易溶于水的杂质;
(6)1.1mol三氯化磷完全反应需要3.3mol乙醇,而实际加入3mol乙醇,故乙醇不足,理论上得到亚磷酸三乙酯为1mol,其质量为166g,其产率为(138g÷166g)×100%=83.1%;
故答案为:83.1%.
点评 本题考查了有机物的制备实验,涉及化学仪器识别、对试剂与操作的分析平衡、化学平衡移动、物质的分离提纯、产率计算等,侧重考查学生分析解决问题能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,7.8gNa2S和Na2O2固体中含有的阴离子总数为0.1NA | |
| C. | 5.6gFe与标准状况下2.24L氯气充分反应失去电子数为0.3NA | |
| D. | 标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
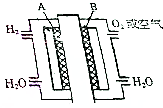 为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;
为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| B. | 20℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| C. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL | |
| D. | 20℃时,0.2mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
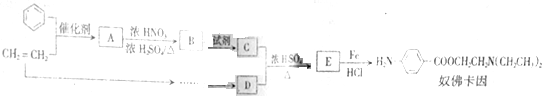
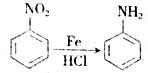
 ,生成A的反应类型为加成反应.
,生成A的反应类型为加成反应.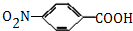 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
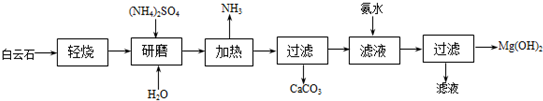
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的Na2CO3溶液中所含钠离子总数为2NA | |
| B. | 标准状况下,22.4L NO与足量O2充分反应,生成的NO2分子数为NA | |
| C. | 常温下,1mol SiC中含有Si-C键的数目为4NA | |
| D. | 常温常压下,33.6L 氯气与足量的铝充分反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
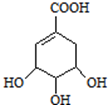 ,如图是以莽草酸A为原料的有机合成路线.
,如图是以莽草酸A为原料的有机合成路线.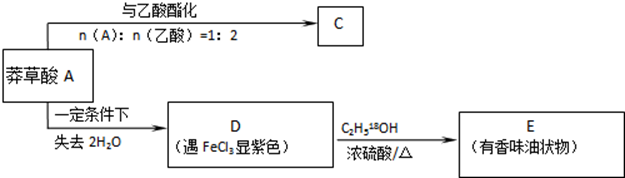
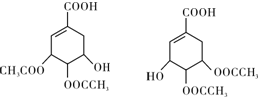
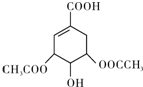 (任写一种).
(任写一种). .
.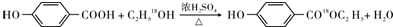 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com