
| ʱ�䣨min�� | 0 | 5 | 10 | 15 | 20 |
| c��CO2����mol/L�� | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
���� ��1�����ݱ���CO2��Ũ�ȱ仯�ж�ƽ��״̬��Ȼ����ݶ�����̼��Ũ�ȱ仯���CO��Ũ�ȱ仯���ٸ���v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�����ƽ�ⳣ��ָ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ���н��
��2��ƽ�ⳣ��ֻ���¶ȵı仯���仯�������¶ȶ�ƽ���Ӱ�������
��3�����һ��ʼ����0.04mol��CO��0.04mol��H2O��0.08mol��CO2��0.08mol��H2���뿪ʼʱ����0.12mol��CO��0.12mol��H2O��Ϊ��Чƽ�⣬�����������£��ﵽƽ��״̬ʱ��CO�����ʵ���Ũ����ȣ�
��4�����淴Ӧ������һ�ַ�Ӧ���Ũ�ȣ�����һ�ַ�Ӧ���ת���ʻ���������ˮ���������ʵ���ʹ������������������ֻ����һ�ַ�Ӧ�����ƽ�������ƶ��ij̶Ⱥ�С����Ӧ�����ɵĶ�����̼���٣�������̼���������Ӳ������Ի�������ж�����̼�������������С��
��5������Qc=$\frac{c��C{O}_{2}��•c��{H}_{2}��}{c��CO��•c��{H}_{2}O��}$��ƽ�ⳣ��K�Ĵ�С��ϵ�жϣ�
��� �⣺��1����ijһ�ݻ�Ϊ5L���ܱ������ڣ�����0.3mol��CO��0.3mol��H2O������ʼŨ��c��CO��=0.06mol/L��c��H2O��=0.06mol/L��ƽ��ʱc��CO2��=0.03mol/L����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼŨ��/mol•L-1 ��0.06 0.06 0 0
ת��Ũ��/mol•L-1 ��0.03 0.03 0.03 0.03
ƽ��Ũ��/mol•L-1 ��0.03 0.03 0.03 0.03
��Ӧ��ʼ���ﵽƽ��ʱ��ת����COΪc��CO��=0.03mol/L����v��CO��=$\frac{0.03mol/L}{10min}$=0.003mol/��L•min��-1��
���¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ��K=$\frac{c��C{O}_{2}��•c��{H}_{2}��}{c��CO��•c��{H}_{2}O��}$=$\frac{0.03��0.03}{0.03��0.03}$=1��
�ʴ�Ϊ��0.003��1��
��2��ƽ�ⳣ��ֻ���¶ȵı仯���仯����֪CO��g��+H2O��g��?CO2��g��+H2��g����H��0���������¶�ƽ�������ƶ���ƽ�ⳣ��K����
�ʴ�Ϊ��A��
��3�����һ��ʼ����0.04mol��CO��0.04mol��H2O��0.08mol��CO2��0.08mol��H2���뿪ʼʱ����0.12mol��CO��0.12mol��H2O��Ϊ��Чƽ�⣬�����������£��ﵽƽ��״̬ʱ��CO�����ʵ���Ũ����ȣ����Դﵽƽ��״̬ʱ��c��CO��=0.03mol/L��
�ʴ�Ϊ��0.03��
��4�����淴Ӧ������һ�ַ�Ӧ���Ũ�ȣ�����һ�ַ�Ӧ���ת���ʻ����������������¶Ⱥ�������������䣬�ڣ�1��������ƽ����ϵ�У��ٳ���0.12mol ��ˮ���������´ﵽƽ���CO��ת�������ߣ�
����ˮ���������ʵ���ʹ������������������ֻ����һ�ַ�Ӧ�����ƽ�������ƶ��ij̶Ⱥ�С����Ӧ�����ɵĶ�����̼���٣�������̼���������Ӳ������Ի�������ж�����̼�������������С��
�ʴ�Ϊ�����ߣ����ͣ�
��5���ڴ������ں�800��������£���ijһʱ�̲��C��CO��=C��H2O��=0.09mol/L��C��CO2 ��=C��H2��=0.13mol/L��
��ʱ��Ũ����Qc=$\frac{c��C{O}_{2}��•c��{H}_{2}��}{c��CO��•c��{H}_{2}O��}$=$\frac{0.13��0.13}{0.09��0.09}$=2.1��K=1����Ӧ��Ũ��ƫ�ߣ���ƽ�����������ƶ���v��������v���棩��
�ʴ�Ϊ������
���� ���⿼�黯ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ��漰��Ӧ���ʵļ��㡢��ѧƽ���йؼ��㡢��ѧƽ���ƶ���Ӱ�����ء�K��Ӧ�õ�֪ʶ��ע�����ƽ�ⳣ����Ӧ�á�ƽ���ƶ��ı��ʣ�����������ѧ���ķ�����������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 150L2mol•L-1NaCl��Һ | B�� | 70.5L0.5mol•L-1CaCl2��Һ | ||
| C�� | 150L2mol•L-1KCl��Һ | D�� | 75L2mol•L-1AlCl3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl2ˮ������ɫ�Լ�ƿ�ܹⱣ�� | |
| B�� | ʢNaOH��Һ���Լ�ƿ��ĥ�ڲ����� | |
| C�� | FeSO4��Һ����ڼ����������۵��Լ�ƿ�� | |
| D�� | ������Һ�ͽ������ķ����Ƕ����ЧӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ�� ����ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 һ�����Ӿ���ľ�����ͼ������������A��
һ�����Ӿ���ľ�����ͼ������������A��  ��ʾ��������B��
��ʾ��������B��  ��ʾ��
��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
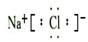 ��
���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com