
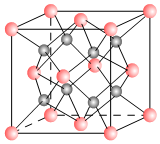
 一种离子晶体的晶胞如图,其中阳离子A以
一种离子晶体的晶胞如图,其中阳离子A以  表示、阴离子B以
表示、阴离子B以  表示.
表示.分析 (1)该晶胞中阴离子个数8、阳离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则阴阳离子个数比=8:4=2:1,若A和B的核外电子排布与Ar相同,则A为Ca元素、B为Cl元素;
(2)根据图知,每个阳离子的配位数是8、每个阴离子的配位数是4;
(3)离子晶体熔沸点与晶格能成正比,晶格能与电荷成正比,与离子半径成反比;
(4)A的离子半径为r m,每个面上处于对角线上的3个阳离子紧邻,则晶胞棱长=$\sqrt{\frac{(4r)^{2}}{2}}$m=2$\sqrt{2}$rm,据此计算晶胞体积.
解答 解:(1)该晶胞中阴离子个数8、阳离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则阴阳离子个数比=8:4=2:1,若A和B的核外电子排布与Ar相同,则A为Ca元素、B为Cl元素,该物质化学式为CaCl2,故答案为:CaCl2;
(2)根据图知,每个阳离子的配位数是8、每个阴离子的配位数是4,故答案为:8;4;
(3)离子晶体熔沸点与晶格能成正比,晶格能与电荷成正比,与离子半径成反比,MgO中氧离子电荷数大于氯化钙中氯离子,且原子半径镁离子小于钙离子、氧离子小于氯离子,所以MgO晶格能大于CaCl2,则MgO熔沸点较高,故答案为:MgO中晶格能大;
(4)A的离子半径为r m,每个面上处于对角线上的3个阳离子紧邻,则晶胞棱长=$\sqrt{\frac{(4r)^{2}}{2}}$m=2$\sqrt{2}$rm,晶胞体积=(2$\sqrt{2}$rm)3=16$\sqrt{2}$r3 m3,
故答案为:16$\sqrt{2}$r3.
点评 本题考查晶胞计算,为高频考点,侧重考查学生分析、判断及空间想象能力,明确晶胞中哪些原子紧邻、离子晶体熔沸点影响因素等知识点是解本题关键,难点是(4)题计算,题目难度中等.


科目:高中化学 来源: 题型:多选题

| A. | 实验室中完成反应③应在坩埚中进行 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 流程中涉及的反应均为非氧化还原反应 | |
| D. | 反应④的产物除了Al,还有O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCO3(s)+O2(g)=Fe2O3(s)+2CO2(g)△H=-130 KJ/mol | |
| B. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+130 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(CO2)(mol/L) | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
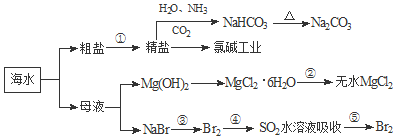
| A. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| B. | 工业生产上向母液中加石灰乳使Mg2+转化为Mg(OH)2沉淀 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
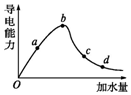 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的平均反应速率为0.3mol/(L•s) | |
| B. | 用物质B表示的平均反应速率为0.6mol/(L•s) | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质B的浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2和CO2一样能够与NaOH溶液反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅酸是一种比碳酸还弱的酸 | |
| D. | 硅的化学性质不活泼,常温下不与任何物质反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com