
| A. | SiO2和CO2一样能够与NaOH溶液反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅酸是一种比碳酸还弱的酸 | |
| D. | 硅的化学性质不活泼,常温下不与任何物质反应 |
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:解答题
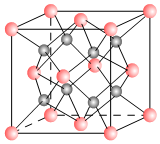 一种离子晶体的晶胞如图,其中阳离子A以
一种离子晶体的晶胞如图,其中阳离子A以  表示、阴离子B以
表示、阴离子B以  表示.
表示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
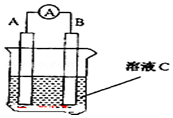 如图原电池装置图:
如图原电池装置图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
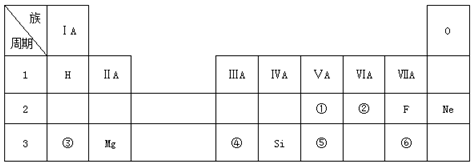
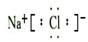 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | CO会与血红蛋白结合,使人中毒;可将中毒病人放入高压氧仓中解毒,其解毒原理符合平衡移动原理 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 固体煤经处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
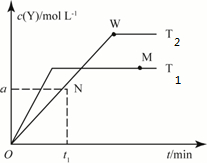 ( )
( )| A. | T2下,在0~t1时间内v(X)=$\frac{a}{{t}_{1}}$mol•L-1•min-1 | |
| B. | N点时气体的总压强大于W点时气体的总压强 | |
| C. | M点的正反应速率小于N点的逆反应速率 | |
| D. | W点时再加入一定量Y,平衡后X的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池铜是正极 | |
| C. | 电子沿导线由锌流向铜,在铜极上氢离子得到电子而放出氢气 | |
| D. | 铜锌原电池工作时,锌溶解,所以才产生电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英、水晶、玛瑙的主要成分都是单质硅 | |
| B. | 硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料 | |
| C. | 实验室存放氢氧化钠溶液的试剂瓶应用细口玻璃瓶并配磨口玻璃塞 | |
| D. | 二氧化硅是一种良好的半导体材料,也是制造光导纤维的一种基本原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com