
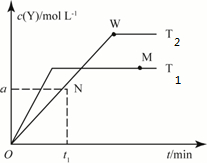
 ( )
( )| A. | T2下,在0~t1时间内v(X)=$\frac{a}{{t}_{1}}$mol•L-1•min-1 | |
| B. | N点时气体的总压强大于W点时气体的总压强 | |
| C. | M点的正反应速率小于N点的逆反应速率 | |
| D. | W点时再加入一定量Y,平衡后X的转化率减小 |
分析 由图可知,T2达到平衡的时间上,则T1>T2,温度高时Y的含量少,则升高温度平衡逆向移动,
A.结合v=$\frac{△c}{△t}$计算;
B.正向进行的程度越大,压强越小;
C.M点正逆反应速率相等,N点正反应速率大于逆反应速率;
D.W点时再加入一定量Y,压强增大,平衡正向移动.
解答 解:A.T2下,在0~t1时间内v(Y)=$\frac{a}{{t}_{1}}$mol•L-1•min-1,则T2下,在0~t1时间内v(X)=$\frac{2a}{{t}_{1}}$mol•L-1•min-1,故A错误;
B.正向进行的程度越大,压强越小,W点正向进行程度大,则N点时气体的总压强大于W点时气体的总压强,故B正确;
C.M点正逆反应速率相等,N点正反应速率大于逆反应速率,则M点的正反应速率大于N点的逆反应速率,故C错误;
D.W点时再加入一定量Y,压强增大,平衡正向移动,X的转化率增大,故D错误;
故选B.
点评 本题考查物质的量随时间的变化曲线,为高频考点,把握图中物质的量变化、温度对反应的影响为解答的关键,侧重分析与应用能力的考查,注意图象与平衡移动的结合,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:解答题
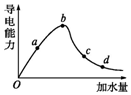 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别甲酸、乙醛、乙酸 | |
| B. | 除去乙烷中少量的乙烯:光照条件下通入氢气 | |
| C. | 除去乙醇中少量的乙酸:加入足量的生石灰,过滤 | |
| D. | 用燃烧的方法鉴别乙醇、苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2和CO2一样能够与NaOH溶液反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅酸是一种比碳酸还弱的酸 | |
| D. | 硅的化学性质不活泼,常温下不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 远洋海轮的外壳连接锌块可保护轮船不受腐蚀 | |
| B. | 铁制器件在潮湿空气中生锈 | |
| C. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| D. | 金属铝在空气中不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积KW随温度、外加酸(碱)浓度的改变而改变 | |
| B. | 能自发进行的化学反应,一定是△H<0、△S>0 | |
| C. | 对已达化学平衡的反应,仅改变浓度,若平衡移动,则平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实现无氰电镀 | B. | 研制可降解塑料 | C. | 使用无铅汽油 | D. | 使用无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
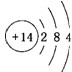 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com