
【题目】常温下,将等质量的铝片、银片、铁片、铜片分别置于四个小烧杯中,然后分别加足量的浓硝酸,放出NO2气体最多的是
A.铝片B.铜片C.铁片D.银片
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.南朝·《竹林七贤与启荣期》砖画的砖块的主要成分是铁的氧化物
B.《本草纲目》中“凡酸坏之酒,皆可蒸烧”,该实验方法可用于分离乙酸和乙酸乙酯
C.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢是铁的合金
D.《本草经集注》中“以火烧之,紫青烟起,乃真硝石也”,对硝酸钾的鉴定过程中利用了硝酸钾的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)![]() Z(g)+W(s) △H>0,下列叙述正确的是
Z(g)+W(s) △H>0,下列叙述正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大活化分子的百分数.有效碰撞次数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下0.1mol/L 的下列溶液①NH4Al(SO4)2②NH3·H2O③NH4Cl④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>②
B. 常温时,pH=2的CH3COOH溶液和pH=12的氨水等体积混合;pH=2的HCl和pH=12的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定相等
C. 常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-)
D. pH=a的氨水稀释到原来的10倍后,其pH=b,则a=b+1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CaCO3和盐酸反应的化学方程式为CaCO3(s)+2HCl===CaCl2+H2O+CO2↑,下列措施中可使生成CO2的速率加快的是(不考虑CaCO3与盐酸接触面积改变的影响)
A. 加大CaCO3的量 B. 加大盐酸的浓度
C. 加大盐酸的量 D. 减小CaCl2的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2和SCl2均为重要的化工原料。
已知:I.S2(l) + Cl2(g)![]() S2Cl2(g) ΔH1;
S2Cl2(g) ΔH1;
II. S2Cl2 (g) +Cl2 (g)![]() 2SCl2 (g) ΔH2;
2SCl2 (g) ΔH2;
III.相关化学键的键能如下表所示:
化学键 | S—S | S—Cl | Cl—Cl |
键能/kJ mol-1 | a | b | c |
请回答下列问题:
(1) SCl2的结构式为______________________。
(2)若反应II正反应的活化能E=dkJ·mol-1,则逆反应的活化能E2=_______kJ·mol-1(用含a、b、c、d的代数式表示)。
(3)—定压强下,向10 L密闭容器中充入1molS2Cl2和1mol Cl2,发生反应II。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示:
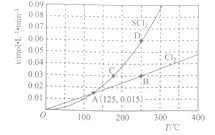
①A、B、C、D四点对应状态下,达到平衡状态的有 ____________(填字母),理由为__________。
②ΔH2_______________0(填“>” “<” 或“=”)。
(4)已知:ΔH1<0。向恒容绝热的容器中加入一定量的S2(l)和Cl2(g),发生反应I,5 min时达到平衡。则3 min时容器内气体压强__________(填“>” “<” 或“=”)5 min时的压强。
(5)—定温度下,在恒容密闭容器中发生反应I和反应II,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率_________(填“增大”“减小”或“不变”),理由为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com