
【题目】下列物质属于电解质的是
A. 盐酸 B. Cu C. 蔗糖 D. K2SO4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.碳酸钠溶液呈碱性,可用于治疗胃酸过多
B.浓度相同的NaNO3溶液和HNO3溶液中NO3-化学性质不同
C.钠的金属性比钾强,工业上用钠制取钾(Na+KCl![]() K↑+NaCl)
K↑+NaCl)
D.既有单质参加,又有单质生成的反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向某 NaOH 溶液中投入一块 Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为_________________________。
(2)实验室常用还原性 Fe 粉与水蒸气反应的实验来研究 Fe 的还原性,则该反应的化学反应方程式为_________________________。
(3)Fe(OH)2 制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为________________________。
(4)实验时制备 Al(OH)3 时,常用可溶性铝盐(如 Al2(SO)4)与氨水反应进行制备。某课外小组在实验时不慎向 Al2(SO)4 溶液中加入了过量 NaOH 溶液,最终并没有制出白色沉淀 Al(OH)3,则该小组同学实验时发生的总离子反应方程式为______________________。
(5)充分煅烧 CoC2O4 后可得到 2.41g 钴的氧化物和 1.344L(标准状况)CO2 气体,则生成钴的氧化物的化学式为________________,煅烧 CoC2O4 的化学反应方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D 为生活中常见金属单质。(反应过程中生成的水及其他产物已略去)
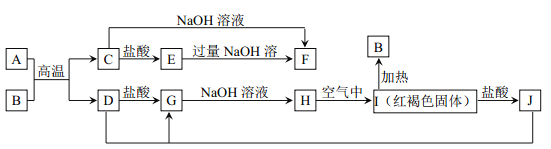
请回答以下问题:
(1)A 是_________,B是_________。(填化学式)
(2)A与B高温反应制得金属 D 的化学反应方程式为________________________。
(3)J的溶液可用来 “刻蚀”铜质电路板,在该刻蚀过程中,所发生反应的离子方程式为_________________________。
(4)检验J中阳离子的试剂是______________________。(写试剂名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、生石膏、冰醋酸、氯化银
④同素异形体:C60、C70、金刚石、石墨
A. ①③ B. ②③ C. ③④ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将 6.00 g 甲加热至完全分解,只得到一种常见金属单质和 6.72 L 的 H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀既可以溶于盐酸,也可溶于 NaOH 溶液。化合物乙在催化剂存在下可分解得到H2 和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回答下列问题:
(1)甲是_______________;乙是______________。( 填化学式)
(2)甲与水反应的化学方程式是____________。
(3)气体丙的分子式是____________。
(4)乙在加热条件下可与 CuO 发生反应,生成红色固体和气体丙,写出该反应的化学方程式________________。
(5)有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证:__________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O;Cu、Cu2O 均可以溶解在 HNO3 溶液中)
(6)甲与乙之间_____________ (填“可能”或“不可能”)发生反应产生H2,判断理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔既是表示微粒,又是表示质量的单位
B.反应前各物质的“物质的量”之和与反应后各物质的“物质的量”之和一定相等
C.氢氧化钠的摩尔质量是40g
D.氩气的摩尔质量在数值上等于它的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
请回答下列问题:
(1)写出硅原子基态时的核外电子排布式:______________。硅元素位于元素周期表的第_________族。
(2)从晶体类型来看,金刚石属于_________晶体。
(3)甲烷分子中碳原子的杂化方式为________。SO42-的空间构型为_______________。
(4)实验测定HF的相对分子质量时,实验测定值一般高于理论值的原因是______________。
(5)NaCl和CsCl熔点高的是 ,(填化学式)其主要原因是 。
(6)CaF2晶胞结构如图所示,该晶体的密度为a g/cm3,则晶胞的体积是 (只要求列出算式)。
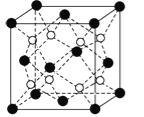
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.相同条件下,溶液中Fe3+、Zn2+ 、Cu2+的氧化性依次减弱
B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
C.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
D.根据反应2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com