
【题目】下列有关有机物物理性质描述错误的是
A.甲醛是一种无色,有强烈刺激性气味的气体,易溶于水,![]() 的甲醛水溶液叫做福尔马林
的甲醛水溶液叫做福尔马林
B.苯酚又名石炭酸、常温下为无色液体,当温度高于![]() 时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
C.甲醇是无色有酒精气味易挥发的液体,有毒,误饮![]() 毫升能双目失明,大量饮用会导致死亡
毫升能双目失明,大量饮用会导致死亡
D.甲酸,无色而有刺激气味的液体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,
,![]() 。
。![]() 时,向
时,向![]() 溶液中滴加氢氧化钠溶液,混合溶液的pOH与
溶液中滴加氢氧化钠溶液,混合溶液的pOH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A.M点溶液中:![]()
B.![]() 的数量级为
的数量级为![]()
C.M点到N点: 的值不变
的值不变
D.N点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是![]()

A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与![]() 溶液发生显色反应
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的沉淀溶解平衡曲线。下列有关说法正确的是( )

A.CaCO3(s)![]() Ca2+(aq)+CO32—(aq) ΔH<0
Ca2+(aq)+CO32—(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25 ℃时CaCO3的Ksp=2.8×10-9
D.温度不变,挥发水分,可使溶液由a点变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的一种质量数为14的原子常用来测定文物的年代;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d64s2。
(1)A、B、C、D四种元素中,电负性最大的是_______________(填元素符号)。
(2)等电子体具有相似的结构和性质。AC与B2、AC2与CAB-均互为等电子体,则AC的电子式为_________。CAB-中A原子的杂化方式为_________。,E能与AC分子形成E(AC)5,其原因是AC分子中含有______________________。
(3)最近发现,只含A、D、E三种元素的一种晶体(晶胞如图所示)具有超导性。A原子的配位数为___________;该晶体的化学式为___________。
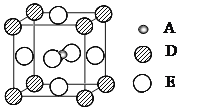
(4)已知C、E形成的一种晶体ExC,晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知该晶体密度为ρ=3.53g/cm3,晶胞边长为5.0×10-10m。则该晶体中x值(精确至0.1)为_______。晶体中的Fen+分别为Fe2+、Fe3+,则Fe2+与Fe3+的比值为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验班)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)![]() Sr2+(aq)+SO
Sr2+(aq)+SO![]() (aq) Ksp=2.5×10-7
(aq) Ksp=2.5×10-7
SrCO3(s)![]() Sr2+(aq)+CO
Sr2+(aq)+CO![]() (aq) Ksp=2.5×10-9
(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________________,该反应的平衡常数为__________________(填具体数字);该反应能发生的原因是
_________________________________________(用沉淀溶解平衡的有关理论解释)。
(2)对于上述反应,实验证明增大CO![]() 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;②增大CO![]() 的浓度,平衡常数K将________。
的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用的试剂为________;实验现象及其相应结论为_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是

A. 拆开2molH2 (g)和1 molO2(g)中的化学键成为H、O原子,共放出1368 kJ能量
B. 由H、O原子形成2 molH2O(g),共吸收1852 kJ能量
C. 2 molH2 (g)和1 molO2 (g)反应生成2 molH2O(1),共吸收484 kJ能量
D. 2 molH2 (g)和1 molO2(g)反应生成2 moIH2O(g),共放出484 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R均为短周期元素(原子序数Y<X<R<Q<Z)。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol/L)的pH和原子半径的关系如图所示。下列说法中正确的是( )

A.X和R的简单离子半径:X < R
B.Z、Q的气态氢化物的稳定性:Z > Q
C.Z的最高价氧化物对应水化物的化学式为HZO3
D.上述五种元素中有两种元素是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com