
【题目】已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的一种质量数为14的原子常用来测定文物的年代;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d64s2。
(1)A、B、C、D四种元素中,电负性最大的是_______________(填元素符号)。
(2)等电子体具有相似的结构和性质。AC与B2、AC2与CAB-均互为等电子体,则AC的电子式为_________。CAB-中A原子的杂化方式为_________。,E能与AC分子形成E(AC)5,其原因是AC分子中含有______________________。
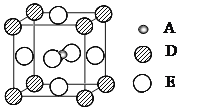
(3)最近发现,只含A、D、E三种元素的一种晶体(晶胞如图所示)具有超导性。A原子的配位数为___________;该晶体的化学式为___________。
(4)已知C、E形成的一种晶体ExC,晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知该晶体密度为ρ=3.53g/cm3,晶胞边长为5.0×10-10m。则该晶体中x值(精确至0.1)为_______。晶体中的Fen+分别为Fe2+、Fe3+,则Fe2+与Fe3+的比值为_______。
【答案】O ![]() sp 孤对电子 6 MgFe3C 0.9 2:7
sp 孤对电子 6 MgFe3C 0.9 2:7
【解析】
根据![]() 可用来测定文物年代,则A为C元素;根据C的基态原子2p能级上的未成对电子数与A原子相同,C为O元素;依据A、B、C、D、E原子序数逐渐增大,可知B为N元素;C2-离子D2+离子具有相同的、稳定的电子层结构,则D是Mg元素;E的基态原子的外围电子排布式为3d64s2,则E是Fe元素,据此解答。
可用来测定文物年代,则A为C元素;根据C的基态原子2p能级上的未成对电子数与A原子相同,C为O元素;依据A、B、C、D、E原子序数逐渐增大,可知B为N元素;C2-离子D2+离子具有相同的、稳定的电子层结构,则D是Mg元素;E的基态原子的外围电子排布式为3d64s2,则E是Fe元素,据此解答。
由以上分析可知:A为C元素;B为N元素;C为O元素;D为Mg元素;E是Fe元素。
(1)A、B、C、D四种元素中,O的非金属性最强,元素的非金属性越强,其电负性越强,故O元素的电负性最强;
(2)AC与B2互为等电子体,即CO与N2互为等电子体,氮气的结构式为N≡N,则CO的结构式为:![]() ,电子式为
,电子式为![]() ;AC2与CAB-均互为等电子体,CO2与CNO-互为等电子体,等电子体的杂化方式相同,已知CO2分子中C原子杂化类型为sp杂化,则CNO-中C原子也是sp杂化;Fe能与CO分子形成Fe(CO)5,该化合物属于配合物,其中CO分子中C原子提供孤对电子,Fe原子提供空轨道;
;AC2与CAB-均互为等电子体,CO2与CNO-互为等电子体,等电子体的杂化方式相同,已知CO2分子中C原子杂化类型为sp杂化,则CNO-中C原子也是sp杂化;Fe能与CO分子形成Fe(CO)5,该化合物属于配合物,其中CO分子中C原子提供孤对电子,Fe原子提供空轨道;
(3)由图可以看出A原子的配位数为6,该晶体的化学式为可以用均摊法求算,C原子在晶胞内部原子数为:1,Mg在晶胞顶点上原子数为:![]() ×8=1,Fe原子在面心上原子数数为:
×8=1,Fe原子在面心上原子数数为:![]() ×6=3,则化学式为:MgFe3C;
×6=3,则化学式为:MgFe3C;
(4)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个FexO,根据密度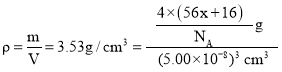 ,解得x=0.9,设Fe0.9O中Fe2+的数目为a,Fe3+的数目为b,结合化合物中化合价代数和为零可得a+b=0.9,2a+3b=2,解得a=0.7,b=0.2,则Fe2+与Fe3+的比值为2:7。
,解得x=0.9,设Fe0.9O中Fe2+的数目为a,Fe3+的数目为b,结合化合物中化合价代数和为零可得a+b=0.9,2a+3b=2,解得a=0.7,b=0.2,则Fe2+与Fe3+的比值为2:7。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】25℃时,取0.lmolL-1HA溶液与0.1molL-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因______(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)所得混合液中各离子浓度从大到小的顺序为:______。
(4)混合液中:c(HA)+c(A-)=______molL-1。
(5)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”)。
(6)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序______(填字母)。
A. NH4HCO3B. NH4AC. NH4HSO4D. NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为_________,价层电子的轨道表达式为_________。
(2)Ni的两种配合物结构如图所示:
A B
①A 的熔、沸点高于B的原因为_________。
②A晶体含有化学键的类型为___________(填选项字母)。
A.σ键 B.π键 C.配位键 D.金属键
③A晶体中N原子的杂化形式是_________。
(3) 人工合成的砷化镍常存在各种缺陷,某缺陷砷化镍的组成为Ni1.2As, 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为_________。
(4) NiAs的晶胞结构如图所示:

①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的砷离子之间的距离为_________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是
A. 苯与液溴的反应:![]()
B. 2-丙醇的催化氧化反应:2CH3CH(OH)CH3 + O2 ![]() 2CH3CH2CHO + 2H2O
2CH3CH2CHO + 2H2O
C. 邻羟基苯甲酸与足量的NaHCO3溶液反应:![]() +2NaHCO3
+2NaHCO3![]()
![]() +2CO2↑+2H2O
+2CO2↑+2H2O
D. 实验室制取乙炔的反应:CaC2+2H2O → Ca(OH)2 + CH≡CH↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物物理性质描述错误的是
A.甲醛是一种无色,有强烈刺激性气味的气体,易溶于水,![]() 的甲醛水溶液叫做福尔马林
的甲醛水溶液叫做福尔马林
B.苯酚又名石炭酸、常温下为无色液体,当温度高于![]() 时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
C.甲醇是无色有酒精气味易挥发的液体,有毒,误饮![]() 毫升能双目失明,大量饮用会导致死亡
毫升能双目失明,大量饮用会导致死亡
D.甲酸,无色而有刺激气味的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
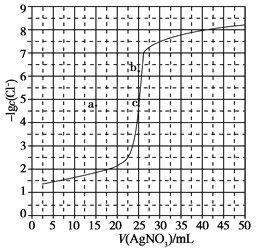
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是有关物质的Ksp:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
Ksp(单位省略) | 2.8×10-9 | 6.8×10-6 | 4.7×10-6 | 5.6×10-12 |
回答下列问题:
(1)___(填“能”或“不能”)直接把贝壳研磨成粉末撒入海水中,使Mg2+转化为MgCO3沉淀,原因是_______。
(2)实际生产中是把Mg2+转化为Mg(OH)2沉淀,而不是转化为MgCO3沉淀,原因是______,请你推测应将贝壳进行怎样的加工处理_____。
(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他_____(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是__________。
(4)要制得无水MgCl2,过滤出Mg(OH)2沉淀后,用试剂_____(填化学式)将其溶解,选择该试剂的理由是__________。
(5)将得到的氯化镁溶液在浓缩池中制得MgCl2·6H2O。然后将MgCl2·6H2O转移到干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1 NaOH溶液滴定10 mL 0.1 mol·L-1 H2X溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是

A.水电离出来的c(OH-):D点>B点
B.C点存在关系式:c(Na+)=c(HX-)+c(X2-)-c(H+)
C.B点:c(HX-)>c(H+)>c(X2-)>c(H2X)
D.A点溶液中加入少量水:![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验溶液中的离子或物质,所用方法正确的是( )
A.加入硝酸银溶液,有白色沉淀生成,证明一定有Cl-存在
B.加入BaCl2溶液和稀硝酸,有白色沉淀生成,证明一定有![]()
C.加入KSCN溶液,有红色物质生成,证明一定含有Fe2+
D.加入淀粉-KI溶液,变蓝色,说明可能有Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com