
����Ŀ���״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ�� CO(g) + 2H2(g) ![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��Ӧ�� CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������ж���H1____0 ������������������������������
�� ij�¶��£���2mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol��L����CO��ת����Ϊ___________����ʱ���¶�Ϊ_______�����ϱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) + 3O2(g) �� 2CO2(g) + 4H2O(l) ��H1����1451.6kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2 ����566.0kJ��mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��_________________________________________
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�

�ٸõ�ص�����ת����ʽΪ___________________________��
�ڹ���һ��ʱ������Һ��pH��С����д���õ�صĸ����ĵ缫��Ӧʽ��_____________________________
���øõ�ص�⣨���Ե缫��500mLijCuSO4��Һ�����һ��ʱ���Ϊʹ�������Һ�ָ���ԭ״̬����Ҫ����Һ�м���9.8g Cu(OH)2���塣��ԭCuSO4��Һ�����ʵ���Ũ��Ϊ___________mol/L��������ǰ����Һ������䣩��
���𰸡�< 80% 250�� CH3OH(l)+O2(g) =CO(g)+2H2O(l) ��H= - 442.8kJ/mol ��ѧ��ת��Ϊ���� CH3OH��6e-+ 8OH- = CO32- + 6H2O 0.2 mol/L
��������
��1�����ɱ������ݿ�֪�������¶�K��С����ѧƽ�������ƶ����淴ӦΪ���ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ���ʡ�H1 <0��
�ڴﵽƽ��ʱ���c��CO��=0.2mol/L��������CO��2mol��0.2mol/L��2L��1.6mol������CO��ת������![]() ��100����80����ƽ��ʱ������Ũ����1.4mol/L���״���0.8mol/L�����Դ�ʱK=
��100����80����ƽ��ʱ������Ũ����1.4mol/L���״���0.8mol/L�����Դ�ʱK=![]() =2.041������¶���250�棻��2����֪�� 2CH3OH(l) + 3O2(g) �� 2CO2(g) + 4H2O(l) ��H1����1451.6kJ��mol���� 2CO (g)+ O2(g) �� 2CO2(g) ��H2 ����566.0kJ��mol�����ݸ�˹���ɣ����١�
=2.041������¶���250�棻��2����֪�� 2CH3OH(l) + 3O2(g) �� 2CO2(g) + 4H2O(l) ��H1����1451.6kJ��mol���� 2CO (g)+ O2(g) �� 2CO2(g) ��H2 ����566.0kJ��mol�����ݸ�˹���ɣ����١�![]() ���ڡ�
���ڡ�![]() �ü״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ��CH3OH(l)+O2(g) =CO(g)+2H2O(l) ��H=��H1��
�ü״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ��CH3OH(l)+O2(g) =CO(g)+2H2O(l) ��H=��H1��![]() ����H2��
����H2��![]() =��1451.6kJ��mol��
=��1451.6kJ��mol��![]() ������566.0kJ��mol����
������566.0kJ��mol����![]() = - 442.8kJ/mol����3���ټ���ȼ�յ����ԭ��أ�����ѧ��ת��Ϊ���ܣ������������£���ظ����ϼ״�ʧ���ӷ���������Ӧ����̼������ӣ��缫��ӦʽΪ ��CH3OH��6e-+ 8OH- = CO32- + 6H2O���ۼ���9.8g Cu��OH��2������ʹ�������Һ�ָ�ԭ״��n[Cu��OH��2]=
= - 442.8kJ/mol����3���ټ���ȼ�յ����ԭ��أ�����ѧ��ת��Ϊ���ܣ������������£���ظ����ϼ״�ʧ���ӷ���������Ӧ����̼������ӣ��缫��ӦʽΪ ��CH3OH��6e-+ 8OH- = CO32- + 6H2O���ۼ���9.8g Cu��OH��2������ʹ�������Һ�ָ�ԭ״��n[Cu��OH��2]=![]() =0.1mol���൱�ڼ���0.1molCuO��0.1molH2O������Cuԭ���غ��n��CuSO4��=n[Cu��OH��2]=0.1mol����c��CuSO4��=
=0.1mol���൱�ڼ���0.1molCuO��0.1molH2O������Cuԭ���غ��n��CuSO4��=n[Cu��OH��2]=0.1mol����c��CuSO4��=![]() =0.2mol/L��
=0.2mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£�ˮ��Һ��c(H��)��c(OH��)����ͼ��ʾ��ϵ�����������������ӹ���˵������ȷ����

A��a���Ӧ����Һ�д������ڣ�CO32-��Na����Cl����SO42-
B��b���Ӧ����Һ�д������ڣ�Fe2+��Ba2����K+��NO3-
C��c���Ӧ����Һ�д������ڣ�Na����Ba2����Cl����Al3+
D��d���Ӧ����Һ�д������ڣ�Na����K����ClO-��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ�����������ͼ��
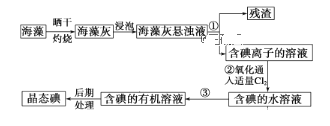
(1)ָ����ȡ��Ĺ����Тٵ�ʵ���������_________��������������______________________________________��
(2)д�����̢����йط�Ӧ�����ӷ���ʽ��_____________________��
(3)�����۵�����_____________���õ�����Ҫ����_____________��
(4)��ȡ��Ĺ����У��ɹ�ѡ����л��Լ�����______����
A.�ƾ� B.���Ȼ�̼ C.���� D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȼ�շ��ⶨij�����л���A�ķ�����ɣ��ⶨװ����ͼ(����̨�����С��ƾ��Ƶ�δ����)��

ȡ17.1 g A����װ���У�ͨ�����O2ȼ�գ�����CO2��H2O����ش������й����⣺
(1)ͨ�����O2��Ŀ��______________________��
(2)Cװ�õ�������_____________________________��Dװ�õ�������_____________________��
(3)ͨ����ʵ�飬�ܷ�ȷ��A���Ƿ�����ԭ�ӣ�__________��
(4)��A��Ħ������Ϊ342 g/mol��Cװ������9.90 g��Dװ������26.4 g����A�ķ���ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��830Kʱ�����ܱ������з������з�Ӧ�� CO��g��+H2O��g��![]() CO2��g��+H2��g�� ��H��0
CO2��g��+H2��g�� ��H��0
�Իش��������⣺
��1������ʼʱc��CO��=2 mol��L-1��c��H2O��=3 mol��L-1���ﵽƽ��ʱCO��ת����Ϊ60%�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K=____________��
��2������ͬ�¶��£�����ʼʱc��CO��=1 mol��L-1��c��H2O��=2 mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5 mol��L-1�����ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬______������������������������ʱv������_______v���棩
��3���������¶ȣ�H2������������÷�Ӧ��Kֵ��___________������Ӧ�����ʽ�__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ļ������γ�(���)1 mol��ѧ��ʱ�ͷ�(������)����������֪����P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ���(kJ/mol) P��P��198��P��O��360��O��O��498����ӦP4(����)+3O2![]() P4O6
P4O6

A. �ų�1 638 kJ����
B. ����1 638 kJ����
C. �ų�126 kJ����
D. ����126 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϣ�ж�����ȼ������ˮʱ�������仯������һ����ȷ����

A. �ס��ҡ��������������е���������С��ϵΪ��>��>��
B. ����1mol H2Oʱ��������245kJ
C. H2O�ֽ�ΪH2��O2ʱ�ų�����
D. ������������������С��ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A (C2H4)�ǻ������л�����ԭ�ϡ���A�ͳ������л���ɺϳ�һ���������Ϻ�һ����ȩ�����ϣ�����ϳ�·����ͼ��ʾ�����ַ�Ӧ������ȥ)��
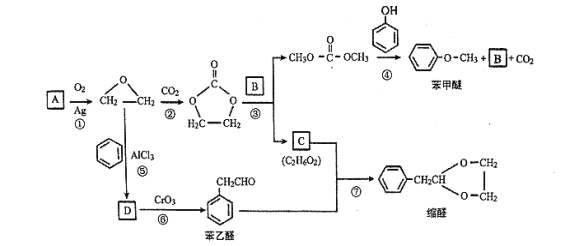
��֪��![]()
�ش��������⣺
��1��B�ķ���ʽ��_______��C�к��еĹ�����������_______��
��2����DΪ��ȡ�������廯��������������Ʒ�Ӧ��ÿ��D������ֻ����1����ԭ�ӣ� D����Ԫ�ص���������ԼΪ13.1%����D�Ľṹ��ʽΪ_______���ķ�Ӧ������_______��
��3���ݱ�������Ӧ�����������£���NaHSO4��H2OΪ�������У���д���˷�Ӧ�Ļ�ѧ����ʽ��_______��
��4����д���������������ı���ȩ������ͬ���칹��Ľṹ��ʽ��_______��
i .���б����ͽṹ![]()
ii.�˴Ź���������4��壬�ҷ����֮��Ϊ3 : 2 : 2 : 1
��5����������EΪ�����ѵ�ͬϵ�����Է��������ȱ����Ѵ�14������ʹFeCl3��Һ��ɫ��E������ͬ���칹�干��_______ (�����������칹)�֡�
��6������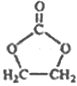 �ĺϳ�·�ߣ�д����2-�ȱ���ͱ�Ҫ�����Լ��Ʊ�
�ĺϳ�·�ߣ�д����2-�ȱ���ͱ�Ҫ�����Լ��Ʊ�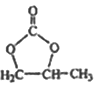 �ĺϳ�����ͼ��_______��
�ĺϳ�����ͼ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ⱦ�������أ�ԭ��֮һ�ǻ�����β���к���NO��NO2��CO�����壬�������糧�ͷų�������NOx��SO2��CO2������Ҳ����ԭ�����ڶ����е�һЩ���������һ�����о���
��1���� CH4����ԭ��������������������������Ⱦ��
��֪����CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) ��H = - 574 kJ/mol
��CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) ��H = - 1160 kJ/mol
��H2O(g) = H2O(l) ��H = - 44.0 kJ/mol
д�� CH4(g)�� NO2(g)��Ӧ���� N2(g)��CO2(g)�� H2O(l)���Ȼ�ѧ����ʽ�� _____________________________________________________________��
��2������β���к���CO��NO2���ж���������������װβ������װ������ʹ�ж�����ת��Ϊ�����塣4CO(g)��2NO2(g) ![]() 4CO2(g)��N2(g) ��H��-1200 kJ��mol-1
4CO2(g)��N2(g) ��H��-1200 kJ��mol-1
���ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T1��������������ͬʱ������ͼ����ȷ����________________������ţ���

��3���û���̿��ԭ��Ҳ���Դ����������ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO��������ӦC(s)+2NO(g) ![]() N2(g)+CO2(g) ��H=a kJ/mol
N2(g)+CO2(g) ��H=a kJ/mol
��T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ���Ũ�����£�
ʱ��/min Ũ��/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
�ٸ���ͼ�����ݷ���T1��ʱ���÷�Ӧ��0-20min��ƽ����Ӧ����v��NO��=_____________________������÷�Ӧ��ƽ�ⳣ��K=____________________��
��30min��ֻ�ı�ijһ�����������ϱ��������жϸı������������_________������ĸ���ţ���
A��ͨ��һ������CO2 B��������ʵĴ���
C���ʵ���С��������� D��ͨ��һ������NO
E������һ�����Ļ���̿
����30min�������¶���T2�����ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ2:1:1����ﵽ��ƽ��ʱNO��ת����____________��������������������������a________0������>������<������
��4���¶�T1��T2ʱ���ֱ�0.50 mol CH4��1.2mol NO2����1 L���ܱ������з�����Ӧ��CH4(g)��2NO2(g)![]() N2(g)��CO2(g)��2H2O(g) ��H=bkJ/mol��
N2(g)��CO2(g)��2H2O(g) ��H=bkJ/mol��
����й��������±���
�¶� | ʱ��/min ���ʵ��� | 0 | 10 | 20 | 40 | 50 |
T1 | n��CH4��/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n��CH4��/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
����˵����ȷ����__________________��
A��T1��T2����b��0
B�����¶�ΪT2����Ӧ���е�40 minʱ�� x��0.15
C���¶�ΪT2ʱ������ƽ�����������ٳ���0.50 mol CH4��1.2mol NO2�����´ﵽƽ��ʱ��n��N2��<0.70mol
D���¶�ΪT1ʱ������ʼʱ�������г���0.50 mol CH4(g)��0.50 molNO2(g)��1.0 mol N2(g)��2.0 molCO2(g)��0.50molH2O(g)����Ӧ��ʼʱ����(��)����(��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com