
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42-
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl—
科目:高中化学 来源: 题型:
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂LiMn2O4)的一种流程如下:
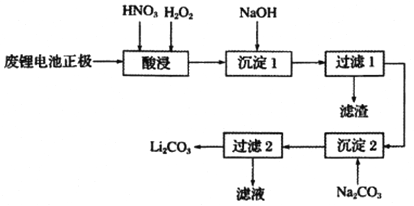
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_______________________________________________________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为 Mn ( NO3)2、LiNO3等产物。请写出该反应离子方程式:_________________________________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是___________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________________________________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成 LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是______________________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入______________________。
(6)味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为85mA·cm-2下电解,180min内去除率达到98.22%。阳极发生的电极反应式是______________________;HClO氧化除去氨氮的反应离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列表格。
物质 | 分子数 | 质量 | 物质的量 | 摩尔质量 |
氮气 | _____ | 14 g | _____ | _____ |
硫酸 | 3.01×1022 | _____ | _____ | _____ |
水 | _____ | _____ | 0.5 mol | 18 g·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.同周期相邻的第ⅡA族和第ⅢA族的元素,原子序数相差1、11或25
B.除短周期外,其它周期均为18种元素
C.副族元素含有非金属元素
D.碱金属元素是指ⅠA族的所有的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s) ![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B. CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0
C. 将容器体积增大为原来的2倍,平衡向正反应方向移动
D. 保持容器体积不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Kolbe法制取乙烯的装置如图所示,电极a上的产物为乙烯和碳酸根离子。下列说法正确的是( )

A. 该装置将化学能转化为电能
B. 图中为阳离子交换膜
C. 阴极周围溶液的pH不断减小
D. 每生成1mol乙烯,电路中转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN、CN-在溶液中存在下列平衡及其对应的平衡常数:①HCN![]() H++ CN- △H 1>0,K1 ②CN-+H2O
H++ CN- △H 1>0,K1 ②CN-+H2O ![]() HCN+OH- △H 2>0,K2,常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
HCN+OH- △H 2>0,K2,常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
A. 混合溶液的pH<7
B. 对混合溶液进行微热,K1 增大、K2 减小
C. K2≈ 1.6×10-5
D. c(Na+) = c(HCN) + c(CN—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
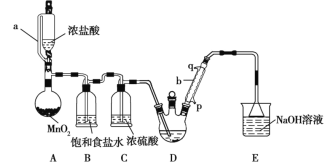
回答下列问题:
(1)用仪器a代替普通分液漏斗的目的是_______________。
(2)装置A中MnO2可以用KMnO4代替,反应可以在常温下进行,试写出反应的离子方程式________________。
(3)仪器b中冷凝水应从_______(填“p”或“q”)口进。
(4)若撤去装置B,对实验的影响是______________。
(5)已知:CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O32-=2I-+S4O62-。称取0.40 g产品,配成待测溶液,加入20.00 mL 0.100 mol/L碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020 mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2S2O3溶液20.00 mL。滴定时所用指示剂是________,达到滴定终点时的现象是______________,测得该产品的纯度为_____。若滴定管用蒸馏水洗净后没有用Na2S2O3溶液润洗,则测定结果将_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1____0 (填“>”、“=”或“<”)。
② 某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为___________,此时的温度为_______(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_________________________________________
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:

①该电池的能量转化形式为___________________________。
②工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。_____________________________
③用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为___________mol/L(假设电解前后溶液体积不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com