
【题目】填写下列表格。
物质 | 分子数 | 质量 | 物质的量 | 摩尔质量 |
氮气 | _____ | 14 g | _____ | _____ |
硫酸 | 3.01×1022 | _____ | _____ | _____ |
水 | _____ | _____ | 0.5 mol | 18 g·mol-1 |
【答案】3.01×1023 0.5 mol 28 g·mol-1 4.9 g 0.05mol 98 g·mol-1 3.01×1023 9g
【解析】
M(N2)=28g·mol-1,n(N2)=![]() =0.5mol,N(N2)=0.5mol×6.02×1023mol-1=3.01×1023;n(H2SO4)=
=0.5mol,N(N2)=0.5mol×6.02×1023mol-1=3.01×1023;n(H2SO4)=![]() =0.05mol, m(H2SO4)=0.05mol×98g·mol-1=4.9 g;M(H2O)=18 g·mol-1,N(H2O)=0.5 mol ×6.02×1023 mol-1=3.01×1023,m(H2O)=0.5 mol×18 g·mol-1=9 g。故答案为:3.01×1023,0.5 mol,28 g·mol-1,4.9 g ,0.05mol, 98 g·mol-1, 3.01×1023,9g。
=0.05mol, m(H2SO4)=0.05mol×98g·mol-1=4.9 g;M(H2O)=18 g·mol-1,N(H2O)=0.5 mol ×6.02×1023 mol-1=3.01×1023,m(H2O)=0.5 mol×18 g·mol-1=9 g。故答案为:3.01×1023,0.5 mol,28 g·mol-1,4.9 g ,0.05mol, 98 g·mol-1, 3.01×1023,9g。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
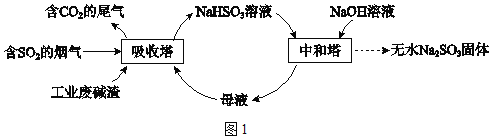
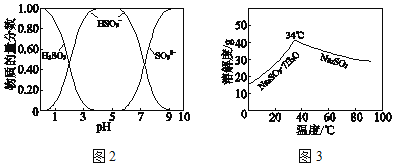
已知:H2SO3、HSO3﹣、SO32﹣在水溶液中的物质的量分数随pH的分布如图2,Na2SO37H2O 和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_____。
②NaHSO3溶液中c(SO32﹣)>c(H2SO3),结合方程式解释其原因:_____。
③已知下列反应:
SO2(g)+2OH﹣(aq)=SO32﹣(aq)+H2O(l) △H1=﹣164.3 kJ/mol
CO2(g)+2OH﹣(aq)=CO32﹣(aq)+H2O(l) △H2=﹣109.4 kJ/mol
2HSO3﹣(aq)=SO32﹣(aq)+SO2(g)+H2O(l) △H3=+34.0kJ/mol
吸收塔中Na2CO3溶液吸收SO2生成HSO3﹣的热化学方程式是__________。
④吸收塔中的温度不宜过高,可能的原因是_____(写出1种即可)。
(3)制备无水Na2SO3
将中和塔中得到的Na2SO3溶液_________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4HS (s)![]() NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
A. 温度、容积不变时,通入HCl气体 B. 分离出一部分NH3
C. 容器体积不变,充入氮气 D. 保持压强不变,充入氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
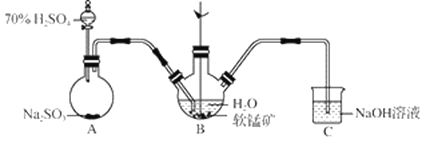
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
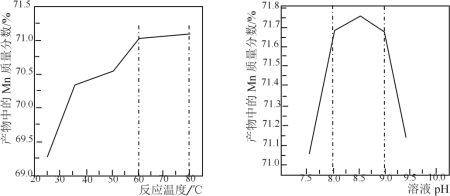
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含有________mol Na+,其质量为________g。
(2)4.5 mol CH4约含有________个CH4,其质量为________g。
(3)3.01×1023个SO42-约含有________mol SO42-,其质量为________g;49 g H3PO4约含有________个H,________个P,________个O,共含有________个原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是( )
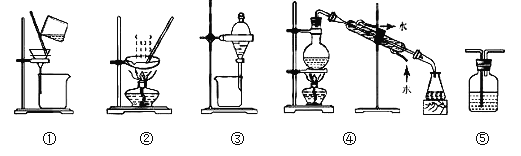
A. 用图①和②所示装置进行粗盐提纯
B. 用乙醇提取碘水中的碘选择图③所示装置
C. 用图④所示装置进行石油分馏实验制取汽油
D. 图⑤所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42-
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
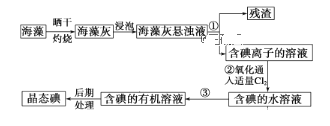
(1)指出提取碘的过程中①的实验操作名称_________及玻璃仪器名称______________________________________。
(2)写出过程②中有关反应的离子方程式:_____________________。
(3)操作③的名称_____________,用到的主要仪器_____________。
(4)提取碘的过程中,可供选择的有机试剂是(______)。
A.酒精 B.四氯化碳 C.甘油 D.醋酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com