
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
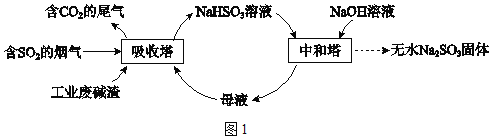
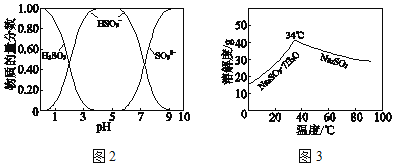
已知:H2SO3、HSO3﹣、SO32﹣在水溶液中的物质的量分数随pH的分布如图2,Na2SO37H2O 和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_____。
②NaHSO3溶液中c(SO32﹣)>c(H2SO3),结合方程式解释其原因:_____。
③已知下列反应:
SO2(g)+2OH﹣(aq)=SO32﹣(aq)+H2O(l) △H1=﹣164.3 kJ/mol
CO2(g)+2OH﹣(aq)=CO32﹣(aq)+H2O(l) △H2=﹣109.4 kJ/mol
2HSO3﹣(aq)=SO32﹣(aq)+SO2(g)+H2O(l) △H3=+34.0kJ/mol
吸收塔中Na2CO3溶液吸收SO2生成HSO3﹣的热化学方程式是__________。
④吸收塔中的温度不宜过高,可能的原因是_____(写出1种即可)。
(3)制备无水Na2SO3
将中和塔中得到的Na2SO3溶液_________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
【答案】CO32﹣+H2OOH﹣+HCO3﹣ 4~5 溶液中,HSO3﹣存在:HSO3﹣H++SO32﹣和HSO3﹣+H2OH2SO3 +OH﹣,HSO3﹣的电离程度强于水解程度 防止SO2的溶解度下降 防止HSO3﹣受热分解,防止HSO3﹣的氧化速率加快等 隔绝空气,加热浓缩至有大量固体析出,高于34℃过滤
【解析】
(1)Na2CO3为强碱弱酸盐,在溶液中CO32-发生水解反应,消耗水电离产生的H+,使溶液解呈碱性,水解的离子方程式为CO32-+H2O![]() OH-+HCO3-;
OH-+HCO3-;
(2)①由图象可知pH在4~5时NaHSO3的物质的量分数最高;
②NaHSO3溶液中存在电离平衡HSO3-![]() H++SO32-和水解平衡HSO3-+H2O
H++SO32-和水解平衡HSO3-+H2O![]() H2SO3+OH-,c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
H2SO3+OH-,c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度;
③已知:①SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) △H1=-164.3kJ/mol
②CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) △H2=-109.4kJ/mol
③2HSO3-(aq)═SO32-(aq)+SO2(g)+H2O(l) △H3=+34.0kJ/mol
利用盖斯定律将①-②-③可得Na2CO3溶液吸收SO2生成HSO3-的热化学方程式为2SO2(g)+CO32-(aq)+H2O(l)=2HSO3-(aq)+CO2(g) △H=-88.9 kJ/mol,
④HSO3-不稳定,易分解,如果温度过高,可导致气体的溶解度下降,且HSO3-易被氧化,因此吸收塔的温度不易过高,否则HSO3-的氧化速率加快等;
(3)得无水Na2SO3固体,温度应高于34℃,且为防止Na2SO3被氧化,要隔绝空气,加热浓缩至有大量固体析出。


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)在操作正确的前提下,提高中和热测定准确性的关键是_________
(2)做1次完整的中和热测定实验,温度计需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?__________,_____________________________
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的是
A | B | C | D | |
目的 | 比较AgCl和AgI的溶解度大小 | 研究浓度对化学平衡的影响 | 研究浓度对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下(T1 <T2),可逆反应2X(g) ![]() 2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(
2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1 molKI与0.1 molFeC13在溶液中反应转移的电子数为0.1NA
B. 镁条在氮气中完全燃烧,生成50g氮化镁时,有1.5NA共用电子对被破坏
C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
D. 标况时,22.4L二氯甲烷所含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂LiMn2O4)的一种流程如下:
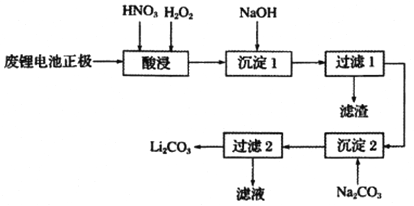
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_______________________________________________________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为 Mn ( NO3)2、LiNO3等产物。请写出该反应离子方程式:_________________________________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是___________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________________________________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成 LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是______________________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入______________________。
(6)味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为85mA·cm-2下电解,180min内去除率达到98.22%。阳极发生的电极反应式是______________________;HClO氧化除去氨氮的反应离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列表格。
物质 | 分子数 | 质量 | 物质的量 | 摩尔质量 |
氮气 | _____ | 14 g | _____ | _____ |
硫酸 | 3.01×1022 | _____ | _____ | _____ |
水 | _____ | _____ | 0.5 mol | 18 g·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com