
ЎҫМвДҝЎҝУГ50mL0.50mol/LСОЛбУл50mL0.55mol/LNaOHИЬТәФЪИзНјЛщКҫөДЧ°ЦГЦРҪшРРЦРәН·ҙУҰЎЈНЁ№эІв¶Ё·ҙУҰ№эіМЦРЛщ·ЕіцөДИИБҝҝЙјЖЛгЦРәНИИЎЈ»ШҙрПВБРОКМвЈә

(1)ФЪІЩЧчХэИ·өДЗ°МбПВЈ¬МбёЯЦРәНИИІв¶ЁЧјИ·РФөД№ШјьКЗ_________
(2)Чц1ҙОНкХыөДЦРәНИИІв¶ЁКөСйЈ¬ОВ¶ИјЖРиК№УГ________ҙОЈ¬ДіН¬С§ОӘБЛКЎИҘЗеПҙОВ¶ИјЖөДВй·іЈ¬ҪЁТйКөСйКұК№УГБҪЦ§ОВ¶ИјЖ·ЦұрІвБҝЛбәНјоөДОВ¶ИЈ¬ДгКЗ·сН¬ТвёГН¬С§өД№ЫөгЈ¬ОӘКІГҙЈҝ__________Ј¬_____________________________
(3)Из№ыУГ60mL0.50mol/LСОЛбУл50mL0.55mol/LNaOHИЬТәҪшРР·ҙУҰЈ¬УлЙПКцКөСйПаұИЈ¬Лщ·ЕіцөДИИБҝ__________(МоЎ°ПаөИЎўІ»ПаөИЎұ)Ј¬ЛщЗуЦРәНИИ__________(МоЎ°ПаөИЎўІ»ПаөИЎұ)Ј¬јтКцАнУЙ ___________ЎЈ
Ўҫҙр°ёЎҝұЈОВ 3 І»Н¬Тв ТтОӘІ»Н¬өДОВ¶ИјЖОуІоІ»Н¬ І»ПаөИ ПаөИ ТтОӘЦРәНИИКЗЦёЛбёъјо·ўЙъЦРәН·ҙУҰЙъіЙ1mol H2OЛщ·ЕіцөДИИБҝЈ¬УлЛбјоөДУГБҝОЮ№Ш
ЎҫҪвОцЎҝ
(1). ФЪІв¶ЁЦРәНИИөДКөСйЦРЈ¬УҰИ·ұЈИИБҝІ»ЛрК§Ј¬ҫЎҝЙДЬМбёЯЧ°ЦГөДұЈОВР§№ыЈ¬№Кҙр°ёОӘЈәұЈОВЈ»
(2). Чц1ҙОНкХыөДЦРәНИИІв¶ЁКөСйЈ¬ТӘ·ЦұрІв¶Ё·ҙУҰЗ°ЛбИЬТәәНјоИЬТәөДОВ¶Иј°·ўЙъЦРәН·ҙУҰКұөДЧоёЯОВ¶ИЈ¬Т»№І3ҙОЈ»ТтІ»Н¬ОВ¶ИјЖөДОуІоІ»Н¬Ј¬ЛщТФІ»ДЬК№УГБҪЦ§ОВ¶ИјЖ·ЦұрІвБҝЛбәНјоөДОВ¶ИЈ¬№Кҙр°ёОӘЈә3Ј»І»Н¬ТвЈ»ТтОӘІ»Н¬өДОВ¶ИјЖОуІоІ»Н¬Ј»
(3). ·ҙУҰ·ЕіцөДИИБҝәНЛщУГЛбТФј°јоөДБҝөД¶аЙЩУР№ШЈ¬ИфУГ60mL 0.50mol/LСОЛбУл50mL0.55mol/LNaOHИЬТәҪшРР·ҙУҰЈ¬УлЙПКцКөСйПаұИЈ¬ЙъіЙЛ®өДБҝФц¶аЈ¬Лщ·ЕіцөДИИБҝТІФц¶аЈ¬ө«ЦРәНИИҫщКЗЗҝЛбәНЗҝјоөДПЎИЬТә·ҙУҰЙъіЙ1molЛ®Кұ·ЕіцөДИИБҝЈ¬УлЛбјоөДУГБҝОЮ№ШЈ¬ФтЛщЗуЦРәНИИөДКэЦөПаөИЈ¬№Кҙр°ёОӘЈәІ»ПаөИЈ»ПаөИЈ»ТтОӘЦРәНИИКЗЦёЛбёъјо·ўЙъЦРәН·ҙУҰЙъіЙ1mol H2OЛщ·ЕіцөДИИБҝЈ¬УлЛбјоөДУГБҝОЮ№ШЎЈ


 ФД¶БҝміөПөБРҙр°ё
ФД¶БҝміөПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЛө·ЁХэИ·өДКЗ
A. ТТНйәНТТП©¶јДЬУГАҙЦЖИЎВИТТНйЈ¬ЗТ·ҙУҰАаРНПаН¬
B. ОЮЛ®ТТҙјұИТҪУГҫЖҫ«өДПы¶ҫР§№ыёьәГ
C. іэИҘјЧНйөДТТП©ҝЙНЁ№эЛбРФёЯГМЛбјШИЬТәПҙЖш
D. јЧұҪәНТТұҪ¶јКЗұҪөДН¬ПөОп
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУГТ»ЦЦКФјБіэИҘПВБРёчОпЦКЦРөДФУЦК(АЁәЕДЪОӘФУЦК)Ј¬ІўРҙіцАлЧУ·ҪіМКҪЎЈ
ЈЁ1Ј©BaCl2(HCl)КФјБ_______Ј¬АлЧУ·ҪіМКҪЈә____________________________________ЎЈ
ЈЁ2Ј©CO2(HCl)КФјБ___________Ј¬АлЧУ·ҪіМКҪЈә__________________________________ЎЈ
ЈЁ3Ј©O2(CO2)КФјБ__________Ј¬АлЧУ·ҪіМКҪЈә____________________________________ЎЈ
ЈЁ4Ј©SO42-(CO32-)КФјБ_______Ј¬АлЧУ·ҪіМКҪЈә__________________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝСх»Ҝ»№Фӯ·ҙУҰ·ўЙъФЪН¬ЦЦФӘЛШЦ®јдөДКЗ(ЎЎЎЎ)
A. Zn+2HCl![]() ZnCl2+H2Ўь
ZnCl2+H2Ўь
B. 2H2S+SO2![]() 3SЎэ+2H2O
3SЎэ+2H2O
C. H2+CuO![]() Cu+H2O
Cu+H2O
D. 2H2O![]() 2H2Ўь+O2Ўь
2H2Ўь+O2Ўь
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЈЁ1Ј©ЗлМоРҙПВұнЈә
ОпЦК | ДҰ¶ыЦКБҝ | ОпЦКөДБҝ | ЦКБҝ | ·ЦЧУ»тАлЧУКэДҝ |
SO2 | ________ | 2 mol | ________ | ________ |
SO42- | ________ | ________ | ________ | 6.02ЎБ1022 |
O2 | ________ | ________ | 8.0 g | ________ |
ЈЁ2Ј©O2әНO3КЗСхФӘЛШөДБҪЦЦөҘЦКЎЈёщҫЭ·ЦЧУКҪ»ШҙрЎЈөИЦКБҝөДO2әНO3Лщә¬·ЦЧУКэЦ®ұИОӘ____Ј¬ФӯЧУёцКэұИОӘ____ЎЈ
ЈЁ3Ј©ДҰ¶ыЦКБҝКЗЦёөҘО»ОпЦКөДБҝөДОпЦКЛщә¬УРөДЦКБҝЎЈ
ўЩТСЦӘNH3өДПа¶Ф·ЦЧУЦКБҝОӘ17Ј¬ФтNH3өДДҰ¶ыЦКБҝОӘ____ЎЈ
ўЪ1.28 gДіЖшМеә¬УРөД·ЦЧУКэДҝОӘ1.204ЎБ1022Ј¬ФтёГЖшМеөДДҰ¶ыЦКБҝОӘ____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ(1)Ді·ҙУҰ№эіМЦРДЬБҝұд»ҜИзНјЛщКҫ, РҙіцёГ·ҙУҰөДИИ»ҜС§·ҪіМКҪ_____________________ЎЈ

(2)ФЪИЬТәЦРҪшРР»ҜС§·ҙУҰөДОпЦК,ЖдЧҙМ¬ұкОӘЎұaqЎұ,ТСЦӘ0.5molөДH2SO4ФЪИЬТәЦРУлЧгБҝЗвСх»ҜДЖИЬТә·ҙУҰ·Еіц57.3 kJөДИИБҝ,УГАлЧУ·ҪіМКҪРҙіцёГ·ҙУҰөДИИ»ҜС§·ҪіМКҪ________________________ЎЈ
(3)әПіЙ°ұ·ҙУҰөДИИ»ҜС§·ҪіМКҪОӘ:3H2(g)Ј«N2(g)![]() 2NH3(g) ЎчH=Јӯ92.2kJ/molЈ¬ТСЦӘәПіЙ°ұ·ҙУҰКЗТ»ёц·ҙУҰОпІ»ДЬНкИ«ЧӘ»ҜОӘЙъіЙОпөД·ҙУҰ,ФЪДіТ»¶ЁМхјюПВN2өДЧӘ»ҜВКҪцОӘ10%,ТӘПлНЁ№эёГ·ҙУҰөГөҪ92.2 kJөДИИБҝ,ЦБЙЩТӘФЪ·ҙУҰ»мәПОпЦРН¶·Е_____mol N2ЎЈ
2NH3(g) ЎчH=Јӯ92.2kJ/molЈ¬ТСЦӘәПіЙ°ұ·ҙУҰКЗТ»ёц·ҙУҰОпІ»ДЬНкИ«ЧӘ»ҜОӘЙъіЙОпөД·ҙУҰ,ФЪДіТ»¶ЁМхјюПВN2өДЧӘ»ҜВКҪцОӘ10%,ТӘПлНЁ№эёГ·ҙУҰөГөҪ92.2 kJөДИИБҝ,ЦБЙЩТӘФЪ·ҙУҰ»мәПОпЦРН¶·Е_____mol N2ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝCO2Ј«Ca(OH)2=CaCO3ЎэЈ«H2OЈ¬CaCO3Ј«CO2Ј«H2O=Ca(HCO3)2Ј¬ЗТCa(HCO3)2ТЧИЬУЪЛ®ЎЈПЦУРCa(OH)2ИЬТәЈ¬ПтЖдИЬТәЦРЦрҪҘНЁИлCO2ЎЈФтПВБРЛДёцНјЦРЈ¬ДЬұИҪПЧјИ·өШ·ҙУііцИЬТәөДөјөзДЬБҰәННЁИлCO2ЖшМеБҝөД№ШПөөДКЗ(xЦбұнКҫCO2НЁИлөДБҝЈ¬yЦбұнКҫөјөзДЬБҰ)
A.  B.
B. 
C.  D.
D. 
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ1molXЖшМеёъa molYЖшМеФЪМе»эҝЙұдөДГЬұХИЭЖчЦР·ўЙъИзПВ·ҙУҰЈәX(g)+aY(g)![]() bZ(g)Ј¬·ҙУҰҙпөҪЖҪәвәуЈ¬ІвөГXөДЧӘ»ҜВКОӘ50%ЎЈ¶шЗТЈ¬ФЪН¬ОВН¬С№ПВ»№ІвөГ·ҙУҰЗ°»мәПЖшМеөДГЬ¶ИКЗ·ҙУҰәу»мәПЖшМеГЬ¶ИөД3/4Ј¬ФтaәНbөДКэЦөҝЙДЬКЗ( )
bZ(g)Ј¬·ҙУҰҙпөҪЖҪәвәуЈ¬ІвөГXөДЧӘ»ҜВКОӘ50%ЎЈ¶шЗТЈ¬ФЪН¬ОВН¬С№ПВ»№ІвөГ·ҙУҰЗ°»мәПЖшМеөДГЬ¶ИКЗ·ҙУҰәу»мәПЖшМеГЬ¶ИөД3/4Ј¬ФтaәНbөДКэЦөҝЙДЬКЗ( )
A. a=1Ј¬b=3 B. a=2Ј¬b=1 C. a=2Ј¬b=2 D. a=3Ј¬b=2
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЦұҪУЕЕ·Еә¬SO2өДСМЖш»бОЈәҰ»·ҫіЎЈАыУГ№ӨТө·ПјоФь(ЦчТӘіЙ·ЦNa2CO3)ҝЙОьКХСМЖшЦРөДSO2ІўЦЖұёОЮЛ®Na2SO3Ј¬ЖдБчіМИзНј1ЎЈ
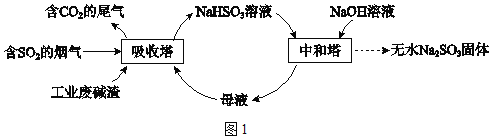
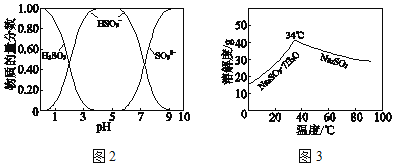
ТСЦӘЈәH2SO3ЎўHSO3©ҒЎўSO32©ҒФЪЛ®ИЬТәЦРөДОпЦКөДБҝ·ЦКэЛжpHөД·ЦІјИзНј2Ј¬Na2SO37H2O әНNa2SO3өДИЬҪв¶ИЗъПЯИзНј3ЎЈ
(1)Na2CO3ИЬТәПФјоРФЈ¬УГАлЧУ·ҪіМКҪҪвКНЖдФӯТтЈә_____ЎЈ
(2)ОьКХСМЖш
ўЩОӘМбёЯNaHSO3өДІъВКЈ¬УҰҝШЦЖОьКХЛюЦРөДpHОӘ_____ЎЈ
ўЪNaHSO3ИЬТәЦРc(SO32©Ғ)Јҫc(H2SO3)Ј¬ҪбәП·ҪіМКҪҪвКНЖдФӯТтЈә_____ЎЈ
ўЫТСЦӘПВБР·ҙУҰЈә
SO2(g)+2OH©Ғ(aq)=SO32©Ғ(aq)+H2O(l) ЎчH1ЈҪ©Ғ164.3 kJ/mol
CO2(g)+2OH©Ғ(aq)=CO32©Ғ(aq)+H2O(l) ЎчH2ЈҪ©Ғ109.4 kJ/mol
2HSO3©Ғ(aq)=SO32©Ғ(aq)+SO2(g)+H2O(l) ЎчH3ЈҪ+34.0kJ/mol
ОьКХЛюЦРNa2CO3ИЬТәОьКХSO2ЙъіЙHSO3©ҒөДИИ»ҜС§·ҪіМКҪКЗ__________ЎЈ
ўЬОьКХЛюЦРөДОВ¶ИІ»ТЛ№эёЯЈ¬ҝЙДЬөДФӯТтКЗ_____ЈЁРҙіц1ЦЦјҙҝЙЈ©ЎЈ
(3)ЦЖұёОЮЛ®Na2SO3
Ҫ«ЦРәНЛюЦРөГөҪөДNa2SO3ИЬТә_________ЈЁМоІЩЧчЈ©Ј¬№эВЛіцөД№ММеУГОЮЛ®ТТҙјПҙөУЎўёЙФпЈ¬өГОЮЛ®Na2SO3№ММеЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com