
【题目】(1)某反应过程中能量变化如图所示, 写出该反应的热化学方程式_____________________。

(2)在溶液中进行化学反应的物质,其状态标为”aq”,已知0.5mol的H2SO4在溶液中与足量氢氧化钠溶液反应放出57.3 kJ的热量,用离子方程式写出该反应的热化学方程式________________________。
(3)合成氨反应的热化学方程式为:3H2(g)+N2(g)![]() 2NH3(g) △H=-92.2kJ/mol,已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少要在反应混合物中投放_____mol N2。
2NH3(g) △H=-92.2kJ/mol,已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少要在反应混合物中投放_____mol N2。
【答案】A(g)+2B(g) =C(l)+3D(l) △H=-432kJ/mo1 H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol 10
【解析】
(1). 据图可知,反应放热,△H<0,该反应的热化学方程式为A(g)+2B(g) =C(l)+3D(l) △H=-432kJ/mo1,故答案为:A(g)+2B(g) =C(l)+3D(l) △H=-432kJ/mo1;
(2). 已知0.5mol H2SO4在溶液中与足量氢氧化钠溶液反应生成1mol水,同时放出57.3 kJ的热量,则用离子方程式表示该反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,故答案为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol;
(3). 在3H2(g)+N2(g)![]() 2NH3(g) △H=-92.2kJ/mol反应中的△H是指1molN2(g)与3molH2(g)完全转化为2mol NH3(g)时放出的热量,要想通过该反应得到92.2kJ的热量,需要1molN2(g)参加反应,若N2的转化率为10%,则需加入的N2(g)的物质的量为1mol÷10%=10mol,故答案为:10。
2NH3(g) △H=-92.2kJ/mol反应中的△H是指1molN2(g)与3molH2(g)完全转化为2mol NH3(g)时放出的热量,要想通过该反应得到92.2kJ的热量,需要1molN2(g)参加反应,若N2的转化率为10%,则需加入的N2(g)的物质的量为1mol÷10%=10mol,故答案为:10。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1 mol N2和3 mol H2置于密闭容器中充分反应,形成N-H键的数目为6 NA
B. 22.4 L D2中含有的中子数目为2 NA
C. 7.8 g Na2O2中含有的离子数为0.4 NA
D. 常温常压下,1 mol氯气与足量的NaOH溶液完全反应转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(![]() )是其中的一种。下列关于该化合物的说法不正确的是
)是其中的一种。下列关于该化合物的说法不正确的是
A. 与环庚烯互为同分异构体 B. 二氯代物共有6种(不含立体异构)
C. 所有碳原子不可能处在同一平面 D. 1mol该化合物含有20mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
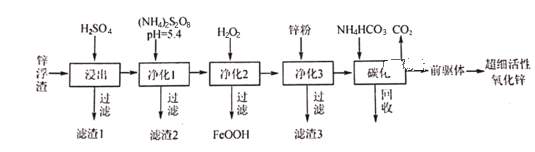
(1)滤渣1的成分为___________。
(2)在S2O82-的结构式中只含有一根“O一O”非极性键,则S的化合价为___________;工业上常用惰性电极电解(NH4)2SO4生产(NH4)2S2O8(过二硫酸铵),阳极电极反应式为__________________。净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:______________________。
(3)净化3的目的_________________________________。
(4)碳化回收溶液的主要成分为___________,该物质循环使用的目的___________________。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)在操作正确的前提下,提高中和热测定准确性的关键是_________
(2)做1次完整的中和热测定实验,温度计需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?__________,_____________________________
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氧化还原反应的分析中合理的是( )
A. Mg变成MgO时化合价升高,失去电子,因此Mg在该反应中被还原了
B. KMnO4受热分解,Mn元素化合价一方面升高,一方面降低,因此Mn元素既被氧化又被还原
C. CuSO4+2NaOH=Cu(OH)2↓+Na2SO4不属于氧化还原反应
D. 反应2H2O![]() 2H2↑+O2↑,H2O中H元素的化合价既有升高,又有降低
2H2↑+O2↑,H2O中H元素的化合价既有升高,又有降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是马路上的第一大杀手。已知酒精(C2H5OH)能与K2Cr2O7和H2SO4的混合溶液在一定条件下发生如下反应:2K2Cr2O7+3C2H5OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,且知Cr2O72-和Cr3+在溶液中分别显橙色和绿色,回答下列问题:
(1)该反应________(填“是”或“不是”)离子反应。
(2)写出Cr2(SO4)3的电离方程式:______________________________________。
(3)该反应________(填“是”或“不是”)氧化还原反应,判断的依据是_________________________________。
(4)你认为能否用这一反应来检测司机是否酒后驾车?________(填“能”或“不能” ),简述其原理________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com