
【题目】下列变化中,不需要破坏化学键的是( )
A. 氯化氢溶于水B. 氯化钠溶于水C. 干冰的升华D. 氯化钠熔化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)某反应过程中能量变化如图所示, 写出该反应的热化学方程式_____________________。

(2)在溶液中进行化学反应的物质,其状态标为”aq”,已知0.5mol的H2SO4在溶液中与足量氢氧化钠溶液反应放出57.3 kJ的热量,用离子方程式写出该反应的热化学方程式________________________。
(3)合成氨反应的热化学方程式为:3H2(g)+N2(g)![]() 2NH3(g) △H=-92.2kJ/mol,已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少要在反应混合物中投放_____mol N2。
2NH3(g) △H=-92.2kJ/mol,已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少要在反应混合物中投放_____mol N2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)9.03×1023个CH4中,含____mol碳原子,___mol氢原子,___mol质子,____mol电子。与___个NH3含有相同数目的氢原子。
(2)与17gNH3所含有分子数相同的氧气的体积(标准状况)是_____L。
(3)某3.65g气体在标准状况下的体积是2.24L,则其摩尔质量是________。
(4)标准状况下9.03×1023个CH4所占的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
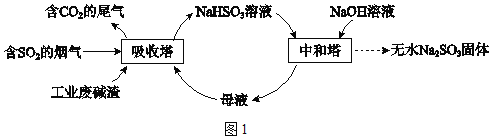
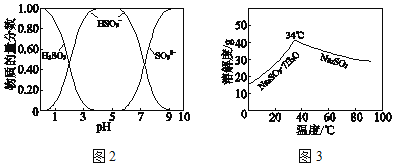
已知:H2SO3、HSO3﹣、SO32﹣在水溶液中的物质的量分数随pH的分布如图2,Na2SO37H2O 和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_____。
②NaHSO3溶液中c(SO32﹣)>c(H2SO3),结合方程式解释其原因:_____。
③已知下列反应:
SO2(g)+2OH﹣(aq)=SO32﹣(aq)+H2O(l) △H1=﹣164.3 kJ/mol
CO2(g)+2OH﹣(aq)=CO32﹣(aq)+H2O(l) △H2=﹣109.4 kJ/mol
2HSO3﹣(aq)=SO32﹣(aq)+SO2(g)+H2O(l) △H3=+34.0kJ/mol
吸收塔中Na2CO3溶液吸收SO2生成HSO3﹣的热化学方程式是__________。
④吸收塔中的温度不宜过高,可能的原因是_____(写出1种即可)。
(3)制备无水Na2SO3
将中和塔中得到的Na2SO3溶液_________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质的溶液,pH由大到小的顺序是___________(填编号)。
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离常数___________(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中水电离出来的c(H+)_________(填“大于”、“等于”或“小于”)醋酸溶液水电离出来的c(H+)。

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______________________(填准确数值)。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时c mol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=_____________________。(用含“ c、a的代数式表示”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 第三周期元素,浓度均为0.01 mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是
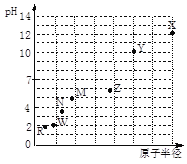
A. 气态氢化物的稳定性:N>R
B. Z的最高价氧化物对应的水化物能溶于稀氨水
C. Y和R形成的化合物既含离子键又含共价键
D. X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa下,0.1 mol甲醇燃烧生成CO2和液态水时放热72.58 kJ,下列热化学方程式正确的是
A. CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=+725.8 kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1451.6 kJ/mol
C. CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
D. 2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1451.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含有________mol Na+,其质量为________g。
(2)4.5 mol CH4约含有________个CH4,其质量为________g。
(3)3.01×1023个SO42-约含有________mol SO42-,其质量为________g;49 g H3PO4约含有________个H,________个P,________个O,共含有________个原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com